2021-2022學年四川省資陽市安岳縣興隆中學高二(上)期中化學試卷
發布:2024/9/12 3:0:9
一、選擇題(本題包括22小題,1-17題,每小題2分,18-22題,每題3分。每小題只有一個選項最符合題意)
-
1.“春蠶到死絲方盡,蠟炬成灰淚始干”是唐代詩人李商隱的著名詩句,下列關于該詩句中所涉及物質的說法錯誤的是( )
A.蠶絲的主要成分是蛋白質 B.古代的蠟是高級脂肪酸酯,屬于高分子聚合物 C.蠶絲屬于天然高分子材料 D.“蠟炬成灰”過程中發生了氧化反應 組卷:271引用:45難度:0.8 -
2.已知NA是阿伏加德羅常數的值,下列說法錯誤的是( )
A.3g3He含有的中子數為1NA B.22.4L(標準狀況)氮氣中含有7NA個中子 C.1molK2Cr2O7被還原為Cr3+轉移的電子數為6NA D.48g正丁烷和10g異丁烷的混合物中共價鍵數目為13NA 組卷:1引用:2難度:0.7 -
3.分子式為C4H8O2,且一定條件下能與NaOH溶液反應,其可能結構有(不含立體異構)( )
A.2種 B.4種 C.6種 D.8種 組卷:35引用:2難度:0.5 -
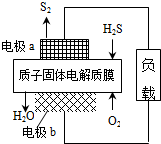 4.H2S廢氣資源化利用途徑之一是回收能量并得到單質硫.反應原理為:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ?mol-1.如圖為質子膜H2S燃料電池的示意圖.下列說法正確的是( )
4.H2S廢氣資源化利用途徑之一是回收能量并得到單質硫.反應原理為:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ?mol-1.如圖為質子膜H2S燃料電池的示意圖.下列說法正確的是( )A.電極a為電池的正極 B.電極b上發生的電極反應為:O2+2H2O+4e-=4 OH- C.電路中每流過4mol電子,電池內部釋放632kJ熱能 D.每17gH2S參與反應,有1mol H+經質子膜進入正極區 組卷:460引用:11難度:0.9 -
5.下列對價電子構型為2s22p5的元素描述正確的是( )
A.原子半徑最小 B.原子序數為7 C.第一電離能最大 D.電負性最大 組卷:36引用:9難度:0.7 -
6.下列說法正確的是( )
A.價電子排布式為4s24p3的元素位于第四周期ⅤA族,是p區元素 B.共價化合物中,成鍵元素電負性大的表現為正價 C.分子化學式為[TiCl(H2O)5]Cl2?H2O的配合物中,中心離子是Ti4+,配離子是[TiCl(H2O)5]2+ D.中心原子通過sp2雜化軌道成鍵時,該分子一定為平面三角形結構 組卷:6引用:3難度:0.7 -
7.已知X、Y和Z三種元素的原子序數之和等于42.X元素原子的4p軌道上有3個未成對電子,Y 元素原子的最外層2p軌道上有2個未成對電子.X跟Y可形成化合物X2Y3,Z元素可以形成負一價離子,下列說法正確的是( )
A.X元素原子基態時的電子排布式為[Ar]4s24p3 B.X元素是第四周期第ⅤA族元素 C.Y元素原子的電子排布式為 
D.Z元素具有兩性 組卷:37引用:10難度:0.9 -
8.徐光憲在《分子共和國》一書中介紹了許多明星分子,如H2O2、CO2、BF3、CH3COOH等.下列說法正確的是( )
A.H2O2分子的空間構型為直線形 B.CO2分子為非極性分子 C.BF3分子中的B原子滿足8電子穩定結構 D.CH3COOH分子中C原子均為sp2雜化 組卷:32引用:6難度:0.7
二、解答題
-
25.2019年諾貝爾化學獎授予三位開發鋰離子電池的科學家。TiS2、LiCoO2和LiMnO2等都是他們研究鋰離子電池的載體。回答下列問題:
(1)基態Co原子的價層電子排布圖為,Co2+、Co3+能與NH3、H2O、SCN-等形成配合物,上述配位體中的第二周期元素電負性從小到大順序是。
(2)已知第三電離能數據:I3(Mn)=3246kJ?mol-1,I3(Fe)=2957kJ?mol-1。錳的第三電離能大于鐵的第三電離能,其主要原因是。
(3)據報道,在MnO2的催化下,甲醛可被氧化成CO2,在處理含HCHO的廢水或空氣方面有廣泛應用。HCHO中鍵角CO2中鍵角(填“大于”“小于”或“等于”)。
(4)工業上,采用電解熔融氯化鋰制備鋰,鈉還原TiCl4(g)制備鈦。已知:LiCl、TiCl4的熔點分別為605℃、-24℃,它們的熔點相差很大,其主要原因是。
(5)二氧化鈦晶胞如圖1所示,鈦原子配位數為。氮化鈦的晶胞如圖2所示,圖3是氮化鈦的晶胞截面圖(相鄰原子兩兩相切)。已知:NA表示阿伏加德羅常數,氮化鈦晶體密度為dg?cm-3。氮化鈦晶胞中N原子半徑為pm。 組卷:20引用:2難度:0.3
組卷:20引用:2難度:0.3 -
26.(1)在2L的密閉容器中,充入2molN2和3molH2,在一定條件下發生反應,3s后測得N2為1.9mol,則以H2的濃度變化表示的反應速率為
。
(2)將10molA和5molB放入容積為10L的密閉容器中,某溫度下發生反應:3A(g)+B(g)?2C(g),在最初2s內,消耗A的平均速率為0.06mol?L-1?s-1,則在2s時,容器中C的物質的量濃度為。
(3)以葡萄糖為燃料的微生物燃料電池結構示意圖如圖所示。
①A為生物燃料電池的(填“正”或“負”)極。
②正極反應式為。負極反應式為。
③在電池反應中,每消耗1mol氧氣,理論上能生成標準狀況下CO2氣體L。組卷:7引用:2難度:0.7


