2014-2015學(xué)年山東省菏澤市高(上)化學(xué)寒假作業(yè)(二)
發(fā)布:2024/12/22 22:30:2
一、選擇題
-
1.利用如圖裝置,能完成很多電化學(xué)實(shí)驗(yàn).下列有關(guān)此裝置的敘述中,錯(cuò)誤的是( )
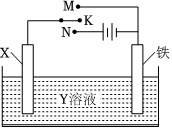
A.若X為鋅棒,Y為NaCl溶液,開關(guān)K置于M處,可減緩鐵的腐蝕,這種方法稱為犧牲陽極陰極保護(hù)法 B.若X為碳棒,Y為NaCl溶液,開關(guān)K置于N處,可減緩鐵的腐蝕,這種方法稱為外加電流陰極保護(hù)法 C.若X為銅棒,Y為硫酸銅溶液,開關(guān)K置于M處時(shí),鐵電極上的電極反應(yīng)式為Cu2++2e→Cu D.若X為銅棒,Y為硫酸銅溶液,開關(guān)K置于N處時(shí),溶液中各離子濃度都不會發(fā)生變化 組卷:42引用:6難度:0.7 -
2.已知Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0,則下列關(guān)于該反應(yīng)的敘述不正確的是( )
A.該反應(yīng)中舊鍵斷裂需要吸收能量,新鍵形成需放出能量,所以總能量不變 B.上述熱化學(xué)方程式中的△H的值與反應(yīng)物的用量無關(guān) C.該反應(yīng)為放熱反應(yīng) D.反應(yīng)物的總能量高于生成物的總能量 組卷:112引用:2難度:0.9 -
3.下列說法正確的是( )
A.書寫熱化學(xué)方程式時(shí),只要在化學(xué)方程式的右端寫上熱量的符號和數(shù)值即可 B.凡是在加熱或點(diǎn)燃條件下進(jìn)行的反應(yīng)都是吸熱反應(yīng) C.把化學(xué)反應(yīng)中物質(zhì)的變化和反應(yīng)的焓變同時(shí)表示出的化學(xué)方程式叫做熱化學(xué)方程式 D.氫氣在氧氣中燃燒的熱化學(xué)方程式是2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ 組卷:13引用:1難度:0.7 -
4.已知下列熱化學(xué)方程式:
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)H2(g)+O2(g)═H2O(l)△H3=-285.8kJ/mol12
則反應(yīng)2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓變?yōu)椋ā 。?/h2>A.-488.3 kJ/mol B.-244.15 kJ/mol C.488.3 kJ/mol D.244.15 kJ/mol 組卷:87引用:23難度:0.7
二、填空題
-
 12.研究NO2、SO2、CO等大氣污染氣體的處理有重要意義。
12.研究NO2、SO2、CO等大氣污染氣體的處理有重要意義。
(1)NO2可用水吸收,相應(yīng)的化學(xué)方程式為。利用反應(yīng)
6NO2+8NH37N2+12H2O也可以處理NO2.當(dāng)轉(zhuǎn)移1.2mol電子時(shí),消耗的NO2在標(biāo)準(zhǔn)狀況下是催化劑△L。
(2)已知:2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ?mol-1
2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ?mol-1
則反應(yīng)NO2(g)+SO2 (g)?SO3 (g)+NO(g)的△H=kJ?mol-1
一定條件下,將與體積比1:2置于密閉容器中發(fā)生上述反應(yīng),下列能說明反映達(dá)到平衡狀態(tài)的是。
a.體系壓強(qiáng)保持不變
b.混合氣體顏色保持不變
c.SO3與NO的體積比保持不變
d.每消耗1molSO3的同時(shí)生成1molNO2
測得上述反應(yīng)平衡時(shí)的NO2與SO2體積比為1:6,則平衡常數(shù)K=。
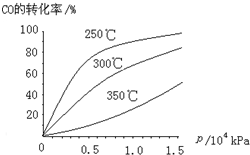
(3)CO可用于合成甲醇,反應(yīng)方程式為CO(g)+2H2 (g)?CH3OH (g)。CO在不同溫度下的平衡轉(zhuǎn)化率與壓強(qiáng)的關(guān)系如圖所示。該反應(yīng)△H0(填“>”或“<”)。實(shí)際生產(chǎn)條件控制在250℃、1.3×104kPa左右,選擇此壓強(qiáng)的理由是。組卷:978引用:25難度:0.5 -
 13.能源的開發(fā)、利用與人類社會的可持續(xù)發(fā)展息息相關(guān),充分利用好能源是擺在人類面前的重大課題.
13.能源的開發(fā)、利用與人類社會的可持續(xù)發(fā)展息息相關(guān),充分利用好能源是擺在人類面前的重大課題.
Ⅰ.已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=a kJ?mol-1
CO(g)+l/2O2(g)=CO2(g)△H=b kJ?mol-1
C(石墨)+O2(g)=CO2(g)△H=c kJ?mol-1
則反應(yīng)4Fe(s)+3O2(g)=2Fe2O3(s)的焓變△H=kJ?mol-1.
Ⅱ.依據(jù)原電池的構(gòu)成原理,下列化學(xué)反應(yīng)在理論上可以設(shè)計(jì)成原電池的是(填序號).
A.C(s)+CO2(g)=2CO(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2H2O(l)=2H2(g)+O2(g)△H>0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H<0
若以稀硫酸為電解質(zhì)溶液,則該原電池的正極反應(yīng)式為.
Ⅲ.氫氣作為一種綠色能源,對于人類的生存與發(fā)展具有十分重要的意義.
(1)實(shí)驗(yàn)測得,在通常情況下,1g H2完全燃燒生成液態(tài)水,放出142.9kJ熱量.則H2燃燒的熱化學(xué)方程式為.
(2)用氫氣合成氨的熱化學(xué)方程式為N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
①一定條件下,下列敘述可以說明該反應(yīng)已達(dá)平衡狀態(tài)的是.
A.υ正(N2)=υ逆(NH3)
B.各物質(zhì)的物質(zhì)的量相等
C.混合氣體的物質(zhì)的量不再變化
D.混合氣體的密度不再變化
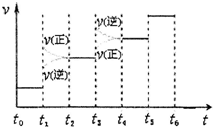
②如圖表示合成氨反應(yīng)達(dá)到平衡后,每次只改變溫度、壓強(qiáng)、催化劑中的某一條件,反應(yīng)速率υ與時(shí)間t的關(guān)系.其中表示平衡混合物中的NH3的含量最高的一段時(shí)間是.圖中t3時(shí)改變的條件可能是.
③溫度為T℃時(shí),將4a mol H2和2a mol N2放入0.5L密閉容器中,充分反應(yīng)后測得N2的轉(zhuǎn)化率為50%,則反應(yīng)的平衡常數(shù)為.組卷:9引用:3難度:0.5


