2020年天津市塘沽一中高考化學模擬試卷(5月份)
發布:2024/11/6 21:0:2
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.下列說法正確的是( )
A.煤的氣化是物理變化,是高效、清潔地利用煤的重要途徑 B.我國研制的重組新冠疫苗無需冷藏 C.將牛油和燒堿溶液混合加熱,充分反應加入熱的飽和食鹽水,上層析出甘油 D.華為繼麒麟980之后自主研發的7nm芯片問世,芯片的主要成分是硅 組卷:44引用:1難度:0.7 -
2.反應2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2可用于工業上制備Na2S2O3.下列化學用語表示正確的是( )
A.中子數為20的硫原子: S2016B.Na+的結構示意圖: 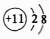
C.Na2S的電子式: 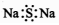
D.CO32-水解的離子方程式:CO32-+2H2O═H2CO3+2OH- 組卷:53引用:3難度:0.8 -
3.下列說法正確的是( )
A.固態二氧化碳屬于共價晶體 B.CH4分子中含有極性共價鍵,所以是極性分子 C.所有的金屬元素都分布在d區和ds區 D.離子鍵、氫鍵、范德華力本質上都是靜電作用 組卷:41引用:1難度:0.8 -
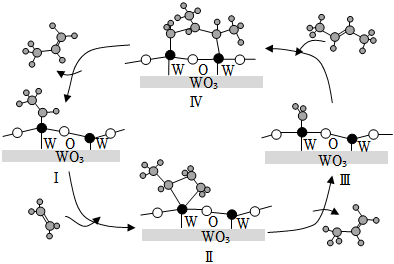 4.科學家提出由 WO3催化乙烯和 2-丁烯合成丙烯的反應歷程如圖(所有碳原子滿足最外層八電子結構)。下列說法不正確的是( )
4.科學家提出由 WO3催化乙烯和 2-丁烯合成丙烯的反應歷程如圖(所有碳原子滿足最外層八電子結構)。下列說法不正確的是( )A.乙烯、丙烯和 2-丁烯互為同系物 B.乙烯、丙烯和 2-丁烯的沸點依次升高 C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式結構 D.碳、鎢(W)原子間的化學鍵在Ⅲ→Ⅳ→Ⅰ的過程中未發生斷裂 組卷:225引用:5難度:0.8 -
5.下列離子方程式不能正確表示體系顏色變化的是( )
A.向AgCl懸濁液中加入Na2S溶液,有黑色難溶物生成:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq) B.向酸性KMnO4溶液中加入NaHSO3固體,溶液紫色褪去:2MnO4-+5SO32-+6H+═2Mn2++5SO42-+3H2O C.向橙色K2Cr2O7溶液中加入NaOH溶液,溶液變黃色:Cr2O72-+2OH-?2CrO42-+H2O D.向稀硝酸中加入銅粉,溶液變藍色:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O 組卷:132引用:6難度:0.6
二、解答題(共4小題,滿分64分)
-
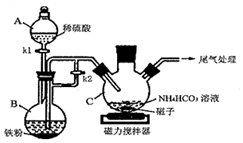 15.乳酸亞鐵晶體{[CH3CH(OH)COO]2Fe?3H2O,相對分子質量為288}易溶于水,是一種很好的補鐵劑,可由乳酸[CH3 CH(OH)COOH]與FeCO3反應制得。
15.乳酸亞鐵晶體{[CH3CH(OH)COO]2Fe?3H2O,相對分子質量為288}易溶于水,是一種很好的補鐵劑,可由乳酸[CH3 CH(OH)COOH]與FeCO3反應制得。
I.碳酸亞鐵的制備(裝置如圖所示)
(1)儀器B的名稱是;實驗操作如下:打開kl、k2,加入適量稀硫酸,關閉kl,使反應進行一段時間,其目的是。
(2)接下來要使儀器C中的制備反應發生,需要進行的操作是,該反應產生一種常見氣體,寫出反應的離子方程式。
(3)儀器C中混合物經過濾、洗滌得到FeCO3沉淀,檢驗其是否洗凈的方法是。
Ⅱ.乳酸亞鐵的制備及鐵元素含量測定
(4)向純凈FeCO3固體中加入足量乳酸溶液,在75℃下攪拌使之充分反應,經過濾,在的條件下,經低溫蒸發等操作后,獲得乳酸亞鐵晶體。
(5)兩位同學分別用不同的方案進行鐵元素含量測定:
①甲同學通過KMnO4滴定法測定樣品中Fe2+的含量計算樣品純度。在操作均正確的前提下,所得純度總是大于100%,其原因可能是。
②乙同學經查閱資料后改用碘量法測定鐵元素的含量計算樣品純度。稱取3.000g樣品,灼燒完全灰化,加足量鹽酸溶解,取所有可溶物配成100mL溶液。吸取25.00 mL該溶液加入過量KI溶液充分反應,然后加入幾滴淀粉溶液,用0.100 mol?L-1硫代硫酸鈉溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),當溶液,即為滴定終點;平行滴定3次,硫代硫酸鈉溶液的平均用量為24.80 mL,則樣品純度為%(保留1位小數)。組卷:73引用:5難度:0.5 -
16.甲醇、乙醇是重要的化工原料,可以用多種方法合成。
(1)已知:H2的燃燒熱為-285.8kJ/mol,CH3OH(l)的燃燒熱為-725.8kJ/mol,CH3OH(g)═CH3OH(l)△H=-37.3kJ/mol,則CO2與H2反應生成甲醇蒸氣和液態水的熱化學方程式為。
(2)若在一恒溫恒容密閉容器中充入1mol CO2和3mol H2模擬工業合成甲醇的反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下列能說明該反應達到平衡狀態的是。
A.混合氣體平均相對分子質量不變
B.混合氣體密度不變
C.容器內壓強恒定不變
D.反應速率滿足以下關系:v正(CO2)=3v逆(H2)
E.CO2、H2、CH3OH、H2O物質的量濃度之比為1:3:1:1
F.單位時間內斷裂3NAH-H鍵的同時形成2mol H-O鍵
(3)將CO2和H2按物質的量之比1:3充入體積為2.0L的恒容密閉容器中反應[生成H2O(g)],圖1表示壓強為0.1MPa和5.0MPa下CO2轉化率隨溫度的變化關系。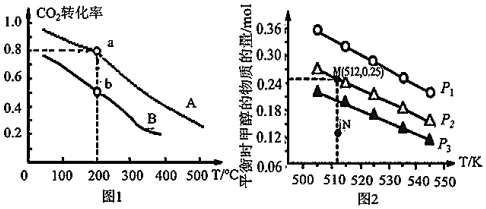
a、b兩點化學反應速率分別用va、vb表示,則vavb。(填“>”、“<”或“=”)
(4)在1.0L恒容密閉容器中投入1mol CO2和2.75mol H2發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),實驗測得不同溫度及壓強下,平衡時甲醇的物質的量變化如圖2所示,下列說法正確的是。
A.該反應的正反應為放熱反應
B.壓強大小關系為p1<p2<p3
C.M點平衡常數K約為1.04×10-2
D.在P2及512K時,圖中N點v(正)<v(逆)
(5)以甲醇為主要原料,電化學合成碳酸二甲酯的工作原理如圖所示。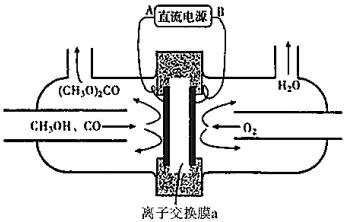
離子交換膜a為(填“陽膜”、“陰膜”),陽極的電極反應式為。
(6)N2H4可作火箭推進劑。已知25℃時N2H4水溶液呈弱堿性:
N2H4+H2O?N2H5++OH-K1=10-a;
N2H5++H2O?N2H62++OH-K2=10-b;
25℃時,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同時c(N2H5+)>c(N2H62+),應控制溶液pH范圍。(用含a、b式子表示)組卷:41引用:1難度:0.5


