2021-2022學年四川省雅安市高二(下)期末化學試卷
發(fā)布:2024/12/8 5:30:3
二、選擇題(共21個小題,每小題只有一個選項符合題目要求。每小題2分,共42分。)
-
1.下列物質屬于弱電解質的是( )
A.NaOH B.Cu C.NH3?H2O D.CH3COONa 組卷:70引用:2難度:0.8 -
2.常溫下,下列物質水溶液呈堿性的是( )
A.NH4Cl B.NaCl C.CuSO4 D.NaHCO3 組卷:32引用:3難度:0.7 -
3.常溫下,0.1mol?L-1下列溶液:①HCl、②H2SO4、③CH3COOH,導電能力強弱順序是( )
A.②>①>③ B.①=②>③ C.①>②>③ D.①=②=③ 組卷:135引用:4難度:0.8 -
4.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH)=10-6mol/L溶液 C.使酚酞試液呈無色的溶液 D.任何鹽溶液 組卷:41引用:2難度:0.9 -
5.常溫下,下列溶液中水的電離程度大于純水的電離程度的是( )
A.0.1mol?L-1鹽酸 B.0.1mol?L-1NaOH溶液 C.0.1mol?L-1NH4Cl溶液 D.0.1mol?L-1NaHSO4溶液 組卷:63引用:2難度:0.7 -
6.下列電池不屬于化學電池的是( )
A.鋰電池 B.太陽能電池 C.燃料電池 D.堿性干電池 組卷:41引用:3難度:0.7 -
7.下列說法正確的是( )
A.水可以用來分離液溴和苯的混合物 B.淀粉和纖維素互為同分異構體 C.C2H4和C4H8一定為同系物 D.植物油氫化過程中發(fā)生了加成反應 組卷:10引用:2難度:0.8 -
8.將室溫下0.1mol?L-1Na2CO3溶液加熱至70℃,其結果正確的是( )
A.溶液中c(CO32-)增大 B.水的電離程度不變 C.Kw將變小 D.溶液的堿性增強 組卷:90引用:2難度:0.5
二、第Ⅱ卷(非選擇題共58分)
-
25.用氧化還原滴定法可以測定市售雙氧水中過氧化氫的濃度(單位g?L-1),實驗過程包括標準溶液的準備和滴定待測溶液。
Ⅰ.準備KMnO4標準溶液
a.配制100.00mLKMnO4溶液備用;
b.準確稱取Na2C2O4基準物質3.35g(0.025mol),配制成250.00mL標準溶液。取出25.00mL于錐形瓶中,加入適量3mol?L-1硫酸酸化后,用待標定的KMnO4溶液滴定至終點,記錄數(shù)據(jù),計算KMnO4溶液的濃度。
Ⅱ.滴定主要步驟
a.取待測雙氧水10.00mL于錐形瓶中;
b.錐形瓶中加入30.00mL蒸餾水和30.00mL3mol?L-1硫酸,然后用已標定的KMnO4溶液(0.1000mol?L-1)滴定至終點;
c.重復上述操作兩次,三次測定的數(shù)據(jù)如下表:
d.數(shù)據(jù)處理。組別 1 2 3 消耗標準溶液體積(mL) 25.00 25.02 24.98
請回答下列問題:
(1)將稱得的Na2C2O4配制成250.00mL標準溶液,所使用的儀器除燒杯和玻璃棒外還有。
(2)標定KMnO4溶液時,能否用稀硝酸調節(jié)溶液酸度(填“能”或“不能”),簡述理由。寫出標定過程中發(fā)生反應的離子方程式。
(3)滴定待測雙氧水時,標準溶液應裝入滴定管,滴定至終點的現(xiàn)象是。
(4)計算此雙氧水的濃度為g?L-1。
(5)誤差分析:在第Ⅱ步滴定主要步驟中,下列操作會使雙氧水濃度測定結果偏高的是。
A.錐形瓶洗凈后用雙氧水潤洗
B.滴定前滴定管尖嘴部分有氣泡,滴定后氣泡消失
C.觀察讀數(shù)時,滴定前仰視,滴定后俯視
D.振蕩錐形瓶時部分液體濺出組卷:22引用:2難度:0.6 -
26.三氧化二鈷(Co2O3)是重要的化工原料。以含鈷廢料(主要成分為Co2O3,含有少量MnO2、NiO、Fe3O4)為原料制備Co2O3的流程如圖:
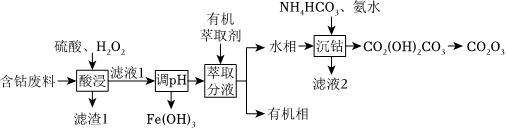
已知:“濾液1”中含有的陽離子有H+、Co2+、Fe3+、Ni2+。
(1)“濾渣1”的主要成分是(寫化學式)。
(2)“酸浸”時,H2O2可將Co2O3還原為Co2+,離子方程式是。
(3)加有機萃取劑的目的是除去(填離子符號)。
(4)“調pH”時,常溫下,為保證Fe3+完全沉淀,需調節(jié)“濾液1”的pH最小值為。(已知:Ksp[Fe(OH)3]=1.0×10-38,當溶液中c(Fe3+)≤1.0×10-5mol/L時,認為沉淀完全)
(5)由“濾液2”可得到的主要副產(chǎn)品是(寫化學式)。
(6)“沉鈷”過程中,生成Co2(OH)2CO3的離子方程式是。組卷:9引用:5難度:0.5


