2022-2023學年福建省泉州市德化一中高二(上)第一次質(zhì)檢化學試卷
發(fā)布:2024/12/3 0:0:2
一、選擇題(本大題共12小題,每小題4分,共48分。在每小題列出的四個選項中,只有一項是最符合題目要求的。)
-
1.2022年北京冬奧會首次使用氫氣作為火炬燃料。下列說法錯誤的是( )
A.推廣氫燃料電池汽車有利于“碳中和” B.氫氣在燃燒的過程中ΔS<0 C.氫氣燃燒生成1molH2O(g)放出的能量比生成1molH2O(l)的少 D.相比液化天然氣,氫氣作為火炬燃料有利于減少酸雨的形成 組卷:20引用:3難度:0.7 -
2.過渡態(tài)理論認為:在反應(yīng)物分子生成產(chǎn)物分子的過程中,首先生成一種高能量的活化配合物,高能量的活化配合物再進一步轉(zhuǎn)化為產(chǎn)物分子。
按照過渡態(tài)理論,NO2(g)+CO(g)═CO2(g)+NO(g)的反應(yīng)歷程如下:
下列有關(guān)說法正確的是( )A.第一步反應(yīng)需要吸收能量 B.活化配合物的能量越高,第一步的反應(yīng)速率越快 C.該反應(yīng)的反應(yīng)速率主要取決于第二步反應(yīng) D.第二步活化配合物之間的碰撞一定是有效碰撞 組卷:19引用:1難度:0.8 -
3.下列敘述中,不能用勒夏特列原理解釋的是( )
A.工業(yè)上采用高壓條件合成氨氣 B.在鉑銠合金催化下縮短N2和H2合成氨的時間 C.Cl2在飽和食鹽水中的溶解程度比在水中的小 D.CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,平衡后,升高溫度體系顏色變深 組卷:28引用:3難度:0.9 -
 4.容積可變的密閉容器中,充入一定量的H2和I2( g)發(fā)生反應(yīng):I2(g)+H2(g)?2HI(g)ΔH<0。t2時刻開始只改變一個條件,反應(yīng)速率與反應(yīng)進程的曲線關(guān)系如圖所示。下列說法不正確的是( )
4.容積可變的密閉容器中,充入一定量的H2和I2( g)發(fā)生反應(yīng):I2(g)+H2(g)?2HI(g)ΔH<0。t2時刻開始只改變一個條件,反應(yīng)速率與反應(yīng)進程的曲線關(guān)系如圖所示。下列說法不正確的是( )A.t0~t2時段,H2的濃度不變即體系達到平衡 B.t2時,改變的條件只有加入催化劑才能實現(xiàn) C.HI的體積分數(shù)最高的時段是t1~t2 D.在t4所處的平衡體系中,再加入H2,則I2的轉(zhuǎn)化率增大 組卷:30引用:1難度:0.7 -
5.一定溫度下,恒容密閉容器中發(fā)生反應(yīng):Fe2O3( s)+3CO(g)=2Fe(s)+3CO2( g),以下能說明該反應(yīng)已達到平衡狀態(tài)的是( )
A.氣體密度不再變化 B.CO的消耗速率與CO2的生成速率相等 C.體系的壓強不再發(fā)生變化 D.CO的物質(zhì)的量與CO2物質(zhì)的量相等 組卷:12引用:1難度:0.6
二、填空題(本大題共4道題,共52分。)
-
16.某興趣小組用如圖所示裝置研究電化學相關(guān)問題。當閉合該裝置的電鍵時,觀察到電流表的指針發(fā)生了偏轉(zhuǎn)。
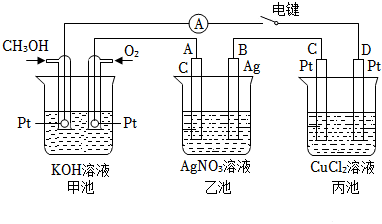
請回答下列問題:
(1)甲池為(填“原電池”或“電解池”),通入CH3OH電極的電極反應(yīng)式為。
(2)乙池中A(石墨)電極的名稱為(填“正極”、“負極”、“陰極”或“陽極”),總反應(yīng)式為。
(3)當乙池中B極質(zhì)量增加5.40g時,甲池中理論上消耗O2的體積mL(標準狀況下),丙池中極(填“C”或“D”)析出g銅。組卷:17引用:1難度:0.5 -
17.(1)NOx的排放主要來自于汽車尾氣。NO可利用活性炭進行吸附。反應(yīng)原理為:C(s)+2NO(g)?N2(g)+CO2(g)ΔH=-34.0kJ?mol-1。在恒壓密閉容器中加入足量的C和一定量的NO氣體,測得NO的轉(zhuǎn)化率隨溫度的變化如圖所示:
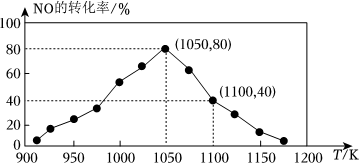
①由圖可知,反應(yīng)在溫度1050K之前,NO的轉(zhuǎn)化率隨溫度升高而增大,其原因可能是;在1100K時,CO2的體積分數(shù)為。
②用物質(zhì)的平衡分壓代替其物質(zhì)的量濃度也可以表示化學平衡常數(shù)(記作Kp)。在1050K、1.1×106Pa時,該反應(yīng)的化學平衡常數(shù)Kp=[已知:氣體分壓P分=氣體總壓(P總)×氣體物質(zhì)的量分數(shù)]。
(2)反應(yīng)A(g)+3B(g)?2C(g)ΔH<0在恒容條件下進行。改變反應(yīng)條件,平衡體系歷經(jīng)階段Ⅰ→Ⅱ→Ⅲ。在第Ⅲ階段體系中各物質(zhì)濃度隨時間變化的曲線如圖所示。達到第三次平衡后,將容器的體積擴大一倍,假定10min后達到新的平衡,請在圖中用曲線表示第IV階段體系中各物質(zhì)的濃度隨時間變化的趨勢。(曲線上必須標出A、B、C)。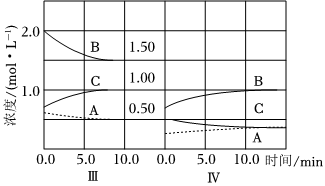 組卷:8引用:1難度:0.5
組卷:8引用:1難度:0.5


