2015-2016學年上海市金山中學高三(上)開學化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題共10分,每小題2分,只有一個正確選項)
-
1.調(diào)查發(fā)現(xiàn),經(jīng)過裝修的居室中裝修材料會緩慢釋放出某些化學物質(zhì),這些物質(zhì)濃度過高,會危害人的身體.這些污染物中最常見的是( )
A.甲醛 B.一氧化碳 C.二氧化硫 D.臭氧 組卷:6引用:3難度:0.9 -
2.下列各組物質(zhì)按混合物,純凈物,弱電解質(zhì)分類正確的是( )
A.鋁熱劑、液氯、苯酚 B.苦鹵、氫氧化鋁膠體、氨水 C.漂粉精、鹽酸、碳酸氫鈉 D.純堿、醋酸、硫酸鋇 組卷:32引用:3難度:0.9 -
3.下列獲取物質(zhì)的方法,不正確的是( )
A.用電石和飽和食鹽水制取乙炔 B.通過石油分餾得到甲烷、乙烯和苯 C.用碳酸鈉和氫氧化鈣反應制氫氧化鈉 D.將氯氣通入氫氧化鈉溶液得到漂白液 組卷:58引用:3難度:0.7 -
4.下列各種物質(zhì)中,所含化學鍵類型完全相同,晶體類型也完全相同的是( )
A.CO2、H2O B.NaOH、Na2O C.NaCl、HCl D.SO2、SiO2 組卷:13引用:3難度:0.7 -
5.雙氧水是二元弱酸,則下列有關(guān)化學用語使用正確的是( )
A.H2O2的電子式: 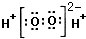
B.雙氧水的電離方程式為H2O2?H++ HO-2C.16 離子中,質(zhì)量數(shù)之和是電子數(shù)之和的兩倍O2-2D.將雙氧水溶液加熱升溫后,溶液pH一定減小 組卷:7引用:2難度:0.9
二、選擇題(本題共36分,每小題3分,只有一個正確選項)
-
6.化學在生產(chǎn)和日常生活中有著重要的應用.下列說法不正確的是( )
A.明礬水解形成的Al(OH)3膠體能吸附水中懸浮物,可用于水的凈化 B.在海輪外殼上鑲?cè)脘\塊,可減緩船體的腐蝕速率 C.MgO的熔點很高,可用于制作耐高溫材料 D.電解MgCl2飽和溶液,可制得金屬鎂 組卷:519引用:38難度:0.5 -
7.下列各組物質(zhì)中,每種物質(zhì)都能被氧化又能被還原的是( )
A.F2、Cl2、CuSO4 B.Cl2、Al、H2 C.H2S、HCl、H2O2 D.F2、K、HCl 組卷:114引用:3難度:0.9 -
8.下列推斷正確的是( )
A.SiO2是酸性氧化物,能與NaOH溶液反應 B.Na2O、Na2O2組成元素相同,與CO2反應產(chǎn)物也相同 C.CO、NO、NO2都是大氣污染氣體,在空氣中都能穩(wěn)定存在 D.新制氯水顯酸性,向其中滴加少量紫色石蕊試液,充分振蕩后溶液呈紅色 組卷:836引用:73難度:0.9 -
9.在下列各溶液中,離子一定能大量共存的是( )
A.pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ B.在強堿性溶液中:Na+、K+、AlO 2-、Cl- C.無色溶液中:Fe3+、MnO4-、Cl-、H+ D.由水電離的c(H+)=1.0×10-12 mol?L-1的溶液中:ClO-、Na+、 、K+SO2-3組卷:5引用:3難度:0.7 -
10.下列敘述正確的是( )
A.1.00mol NaCl中含有6.02×1023個NaCl分子 B.1.00mol NaCl中,所有Na+的最外層電子總數(shù)為8×6.02×1023 C.欲配制1.00L,1.00mol?L-1的NaCl溶液,可將58.5g NaCl溶于1.00L水中 D.電解58.5g 熔融的NaCl,能產(chǎn)生22.4L氯氣(標準狀況)、23.0g金屬鈉 組卷:41引用:3難度:0.7
十、(本題共13分)
-
30.實驗室一試劑瓶的標簽嚴重破損,只能隱約看到下列一部分“
 ”取該試劑瓶中的試劑,通過燃燒實驗測得:16.6g 該物質(zhì)完全燃燒得到39.6g CO2與9g H2O.
”取該試劑瓶中的試劑,通過燃燒實驗測得:16.6g 該物質(zhì)完全燃燒得到39.6g CO2與9g H2O.
(1)通過計算可知該有機物的分子式為:.
(2)進一步實驗可知:
①該物質(zhì)能與碳酸氫鈉溶液反應生成無色無味氣體.
②16.6g 該物質(zhì)與足量金屬鈉反應可生成氫氣2.24L(已折算成標準狀況).
則該物質(zhì)的結(jié)構(gòu)可能有種,請寫出其中任意兩種同分異構(gòu)體的結(jié)構(gòu)簡式.
(3)若下列轉(zhuǎn)化中的D是(2)中可能結(jié)構(gòu)中的一種,且可發(fā)生消去反應;E含兩個六元環(huán);取C在NaOH水溶液中反應后的混合液,加入足量硝酸酸化后,再加入硝酸銀溶液,出現(xiàn)白色沉淀.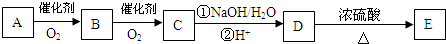
A的結(jié)構(gòu)簡式為.
(4)寫出A轉(zhuǎn)化成B的化學方程式:.
(5)反應類型:C→D的①,D→E.組卷:11引用:2難度:0.5
十一、(本題共16分)
-
31.為測定一置于空氣中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同學準確量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入過量BaCl2溶液,充分反應后過濾、洗滌、干燥,得到沉淀28.0g;再另取同樣的FeSO4溶液200mL,向其中加入過量NaOH溶液,攪拌使其充分反應,待沉淀全部變?yōu)榧t褐色后,過濾、洗滌并灼燒所得固體,最終得固體8.0g.
(1)寫出反應中涉及的化學方程式(至少3個)
(2)通過計算,填寫下表:
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的總的物質(zhì)的量的濃度c(H+) c(SO42-) c(Fe2+、Fe3+)
(3)計算原溶液中Fe2+被氧化的百分率.組卷:4引用:2難度:0.3


