2016-2017學年河南省駐馬店市正陽二中高二(上)周日化學試卷(二)
發布:2024/4/20 14:35:0
一.選擇題
-
1.下列有關NA的敘述正確的是( )
A.某無水乙醇與足量金屬鈉反應生成5.6LH2(標況),則該乙醇分子中共價鍵總數為4NA B.標況下,22.4L甲烷與22.4L氯氣在光照下充分反應,生成的CH3Cl分子數一定為NA C.在密閉容器中加入1.5 mol H2和0.5 mol N2,充分反應后得到NH3分子數為NA D.常溫常壓,56g鐵片投入足量濃硫酸中生成SO2分子數為NA 組卷:6引用:4難度:0.7 -
2.下列有關實驗用品的使用或操作的敘述中,正確的是( )
A.用藍色石蕊試紙檢驗溶液的酸性 B.量筒可用于配制溶液,但不能作為反應容器使用 C.配制稀硫酸時,先向燒杯中注入濃硫酸,再加水稀釋 D.向燃著的酒精燈中加酒精 組卷:7引用:2難度:0.7 -
3.下列說法中正確的是( )
A.在一定溫度和壓強下,各種氣態物質體積大小由構成氣體分子大小決定 B.在一定溫度和壓強下,各種氣態物質體積的大小由構成氣體的分子數決定 C.不同的氣體,若體積不同,則它們所含的分子數一定不同 D.氣體摩爾體積是指1mol任何氣體所占的體積約為22.4L。 組卷:267引用:24難度:0.9 -
4.能正確表示下列反應的離子方程式是( )
A.NH4HCO3溶液中加入足量NaOH溶液共熱:NH+4+OH- NH3↑+H2O△B.過量的鐵與濃硝酸反應:Fe+6H++3 ═Fe3++3NO2↑+3H2ONO-3C.硫酸亞鐵酸性溶液中加入過氧化氫:2Fe2++H2O2+2H+═2Fe3++2H2O D.用食醋溶解水垢:CaCO3+2H+═Ca2++CO2↑+H2O
Mg(OH)2+2H+═Mg2++2H2O組卷:4引用:2難度:0.7 -
5.在pH=13的無色溶液中,可以大量共存的一組離子是( )
A. 、NH+4、K+、NO-3SO2-4B. 、CO2-3、NO-3、Na+HCO-3C.Na+、ClO-、 、AlO-2NO-3D.Cu2+、K+、Na+、 SO2-4組卷:126引用:10難度:0.7 -
6.下列說法正確的是( )
A.往某溶液中加入稀NaOH溶液,無刺激性氣味的氣體產生,說明該溶液一定不含 NH+4B.用加熱的方法可以除去混在NaCl固體中的NH4Cl,說明NH4Cl會升華 C.SO2氣體和Cl2均能使品紅溶液褪色,說明兩者均有強氧化性 D.濃硫酸可用來干燥H2、Cl2、SO2等氣體,說明濃硫酸具有吸水性 組卷:64引用:7難度:0.9 -
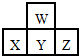 7.如圖是周期表中短周期的一部分.若X原子最外層電子數比次外層電子數少3個,則下列說法中不正確的是( )
7.如圖是周期表中短周期的一部分.若X原子最外層電子數比次外層電子數少3個,則下列說法中不正確的是( )A.原子半徑的大小順序是Z>Y>X>W B.Z的氣態氫化物比X的氣態氫化物穩定 C.X、Y、Z各元素最高價和最低價的絕對值之和為8 D.X、Y、Z最高價氧化物對應水化物的酸性強弱關系Z>Y>X 組卷:12引用:4難度:0.7
二.非選擇題
-
 22.甲醇可以與水蒸氣反應生成氫氣,反應方程式如下:
22.甲醇可以與水蒸氣反應生成氫氣,反應方程式如下:
CH3OH(g)+H2O(g)?CO2(g)+3H2(g);△H>0
(1)一定條件下,向體積為2L的恒容密閉容器中充入1molCH3OH(g)和3molH2O(g),20s后,測得混合氣體的壓強是反應前的1.2倍,則用甲醇表示該反應的速率為.
(2)判斷(1)中可逆反應達到平衡狀態的依據是(填序號).
①v正(CH3OH)═3v逆(H2) ②混合氣體的密度不變 ③混合氣體的平均相對分子質量不變 ④CH3OH、H2O、CO2、H2的濃度都不再發生變化
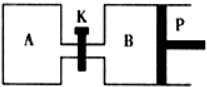
(3)圖1中P是可自由平行滑動的活塞,關閉K,在相同溫度時,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),兩容器分別發生上述反應. 已知起始時容器A和B的體積均為aL,反應達到平衡時容器B的體積為1.5aL,容器B中CH3OH轉化率為;維持其他條件不變,若打開K一段時間后重新達到平衡,容器B的體積為L(連通管中氣體體積忽略不計,且不考慮溫度的影響).組卷:76引用:6難度:0.5 -
 23.甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上一般可采用如下反應來合成甲醇(于固定容器中進行):2H2(g)+CO(g)?CH3OH(g)
23.甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上一般可采用如下反應來合成甲醇(于固定容器中進行):2H2(g)+CO(g)?CH3OH(g)
(1)如表所列數據是該反應在不同溫度下的化學平衡常數(K)
①該反應的平衡常數表達式K=溫度 250℃ 300℃ 350℃ K 2.041 0.270 0.012 ,△H0(填“>”、“<”或“=”).
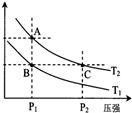
②300℃下,將2mol CO、6mol H2和4molCH3OH充入2L的密閉容器中,判斷反應(填“正向”或“逆向”)進行.
③要提高CO的轉化率,可以采取的措施是(填序號).
a.升溫 b.加入催化劑 c.增加CO的濃度
d.加入H2加壓 e.加入惰性氣體加壓 f.分離出甲醇
(2)如圖表示在溫度分別為T1、T2時,平衡體系中H2的體積分數隨壓強變化曲線,A、C兩點的反應速率AC(填“>”、“=”或“<”,下同),A、C兩點的化學平衡常數AC,由狀態B到狀態A,可采用的方法(填“升溫”或“降溫”).組卷:9引用:2難度:0.3


