2020-2021學年山西省運城市高中聯合體高一(下)調研化學試卷(3月份)
發布:2024/11/24 9:30:6
一、選擇題(本題共16小題,每小題3分,共48分。在每小題給出的四個選項中只有一項是符合題目要求的)
-
1.下列說法正確的是( )
A.濃硫酸與濃硝酸敞口放置都會變稀,兩者原理相同 B.因為SO2具有漂白性,所以它能使品紅溶液和溴水褪色 C.氨易液化,汽化時會吸收大量熱,可作制冷劑 D.某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,證明一定含有SO42- 組卷:11引用:1難度:0.7 -
2.下列反應對應的離子方程式正確的是( )
A.將過量的鐵粉加入稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O B.向Al2(SO4)3溶液中加入過量NH3?H2O:Al3++4NH3?H2O=[Al(OH)4]-+4NH4+ C.向碳酸氫鈣溶液中加入過量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O D.Cu2O與足量稀硝酸反應:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O 組卷:6引用:1難度:0.5 -
3.NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.常溫常壓下,46gNO2和N2O4混合氣體中所含的原子總數為3NA B.反應4FeS2+11O2 2Fe2O3+8SO2,每生成1molFe2O3轉移電子總數為44NA高溫C.常溫下,將5.6g鐵投入足量的濃硫酸中轉移電子數為0.3NA D.密閉容器中,2molSO2和1molO2催化反應后分子總數為2NA 組卷:3引用:3難度:0.7 -
4.在給定條件下,下列物質間轉化均能實現的是( )
A.S SO3O2點燃H2SO4H2OB.N2 NH3H2高溫高壓、催化劑NaHCO3CO2NaCl(aq)C.SiO2 H2SiO3H2O△Na2SiO3NaOHD.NH3 NOO2催化劑、△HNO3H2O組卷:12引用:1難度:0.6 -
5.將SO2氣體分別通入下列溶液中,始終沒有明顯現象的是( )
①Na2SiO3溶液 ②CaCl2溶液 ③Ba(OH)2溶液 ④Ba(NO3)2溶液 ⑤H2S溶液A.①②③ B.①④⑤ C.只有② D.只有③ 組卷:65引用:3難度:0.7 -
6.下列有關硅及其化合物的說法中錯誤的是( )
A.制造光導纖維的主要原料是SiO2 B.碳化硅陶瓷屬于新型無機非金屬材料 C.硅酸鈉屬于鹽,不屬于堿,所以硅酸鈉可以保存在磨口玻璃塞試劑瓶中 D.北斗導航系統計算機的芯片材料是單質硅 組卷:9引用:1難度:0.7
二、非選擇題(本題包括4小題,共52分)
-
19.碳和硅及其化合物的開發由來已久,在現代生活中有廣泛應用。
(1)高純硅是現代信息、半導體和光伏發電等產業都需要的基礎材料。工業上制備高純硅通常第一步是利用石英砂和焦炭在電弧爐中制粗硅,則該反應的化學方程式是。
(2)某同學為了驗證碳酸和硅酸兩種酸的相對強弱,用如圖所示裝置進行實驗。(夾持儀器已略去,氣密性已檢驗)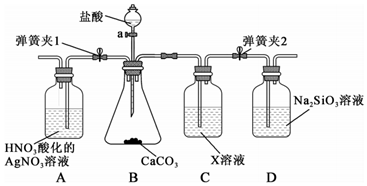
回答下列問題:
①儀器a的名稱:。
②打開彈簧夾1,關閉彈簧夾2,旋開儀器a的活塞滴加鹽酸。一段時間后,A中現象是,原因是。
③關閉彈簧夾1,打開彈簧夾2,D中出現白色膠狀沉淀,X是(填化學式),D中發生反應的化學方程式是。組卷:221引用:2難度:0.5 -
20.氨是一種重要的化工產品,也是重要的化工原料。某化學興趣小組在實驗室制備氨并完成相關性質實驗。
Ⅰ.實驗室制取氨氣通常有兩種方法:①固體氫氧化鈣與氯化銨共熱制備氨氣(裝置如圖甲);②在錐形瓶中加入NaOH固體,在分液漏斗中加入濃氨水制備氨氣(裝置如圖乙)。請回答: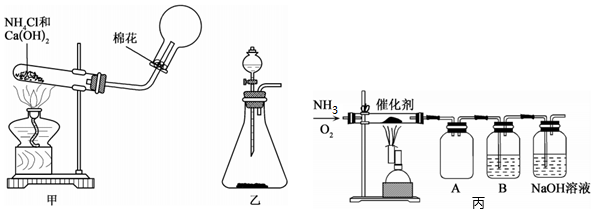
(1)用方法①制備并收集NH3。裝置甲中生成NH3的化學方程式為。用圓底燒瓶收集NH3的方法為(填“向上排空氣法”或“向下排空氣法”),檢驗圓底燒瓶中已收集滿氨氣的方法是。
(2)利用裝置乙可用方法②制取氨氣,利用該裝置還可制取(填字母)等氣體。
a.H2
b.CO2
c.Cl2
Ⅱ.該化學興趣小組設計了如圖丙所示的實驗裝置模擬工業生產制備少量硝酸。
(3)實驗時先用酒精噴燈預熱催化劑,然后通入反應氣體,當催化劑紅熱后移走酒精噴燈,催化劑始終保持紅熱,溫度可達到700℃以上,由此可知該反應是反應(填“吸熱”或“放熱”)。
(4)B中試劑為,NaOH溶液的作用是。
(5)控制氨氣和氧氣的比例是制備硝酸的關鍵。當比例不合適時,A中不僅有紅棕色氣體產生,還伴有白煙,白煙的化學式是。欲使氨氣盡可能完全轉化為,理論上n(NH3):n(O2)的最佳比例為。組卷:114引用:2難度:0.5


