2013-2014學年四川省成都市郫縣一中高三(下)周考化學試卷(九)
發布:2024/12/12 10:30:1
一、選擇題(本題包括14小題,每小題3分,共42分,每小題只有一個選項符合題意)
-
1.下列有關實驗操作或儀器的使用正確的是( )
A. 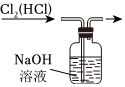
除去氯氣中的氯化氫B. 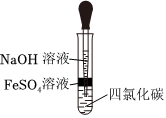
制備Fe(OH)2C. 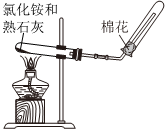
實驗室制備氨氣D. 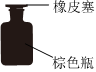
保存濃硝酸組卷:2引用:5難度:0.9 -
2.下列敘述正確的是( )
A.乙醇的核磁共振氫譜有三個峰,峰的高度比為1:2:3 B.“水滴石穿”是因為溶解了CO2的雨水與CaCO3作用生成Ca(HCO3)2 C.CuSO4?5H2O遇濃硫酸顏色變白,說明濃硫酸具有脫水性 D.含有相同種類官能團的物質一定屬于同系物。 組卷:1引用:1難度:0.6 -
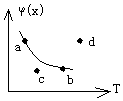 3.可逆反應nx(g)+y(g)?mz(g),為吸熱反應,當反應達到平衡后,混合氣體中x的體積分數φ(x)與溫度(T)的關系如圖所示,a點和b點是反應達到平衡時曲線上的兩點,c點和d點是反應未達到平衡時曲線外的兩點。若密閉容器中以定壓條件進行反應,當V正>V逆時,則在圖中可表明此種情況的點是( )
3.可逆反應nx(g)+y(g)?mz(g),為吸熱反應,當反應達到平衡后,混合氣體中x的體積分數φ(x)與溫度(T)的關系如圖所示,a點和b點是反應達到平衡時曲線上的兩點,c點和d點是反應未達到平衡時曲線外的兩點。若密閉容器中以定壓條件進行反應,當V正>V逆時,則在圖中可表明此種情況的點是( )A.a點 B.b點 C.c點 D.d點 組卷:14引用:1難度:0.8
二、非選擇題(本題共4小題,共58分)
-
10.綠礬(FeSO4?7H2O)是治療缺鐵性貧血藥品的重要成分.下面是以市售鐵屑(含少量錫、氧化鐵等雜質)為原料生產純凈綠礬的一種方法:
已知:室溫下飽和H2S溶液的pH約為3.9,SnS沉淀完全時溶液的pH為1.6;FeS開始沉淀時溶液的pH為3.0,沉淀完全時的pH為5.5.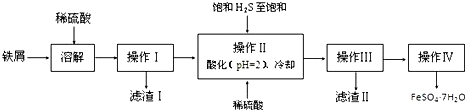
(1)檢驗制得的綠礬晶體中是否含有Fe3+的實驗操作是.
(2)操作Ⅱ中,通入硫化氫至飽和的目的是;在溶液中用硫酸酸化至pH=2的目的是.
(3)操作Ⅳ的順序依次為:、冷卻結晶、.
(4)測定綠礬產品中Fe2+含量的方法是:
a.稱取2.8500g綠礬產品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待測溶液于錐形瓶中;
c.用硫酸酸化的0.01000mol?L-1KMnO4溶液滴定至終點,消耗KMnO4溶液體積的平均值為20.00mL.
①已知KMnO4酸性溶液與Fe2+反應時被還原為Mn2+,請寫出該反應的離子方程式:;
②計算上述樣品中FeSO4?7H2O的質量分數為(用小數表示,保留三位小數).組卷:18引用:2難度:0.5 -
 11.汽車尾氣是城市的主要空氣污染物,研究控制汽車尾氣成為保護環境的首要任務。
11.汽車尾氣是城市的主要空氣污染物,研究控制汽車尾氣成為保護環境的首要任務。
(1)汽車內燃機工作時發生反應:N2(g)+O2(g)2NO(g),是導致汽車尾氣中含有NO的原因之一。T℃時,向5L密閉容器中充入6.5molN2和7.5molO2,在5min時反應達到平衡狀態,此時容器中NO的物質的量是5mol。
①5min內該反應的平均速率υ (NO)=;在T℃時,該反應的平衡常數
K=。
②反應開始至達到平衡的過程中,容器中下列各項發生變化的是(填序號)。
a.混合氣體的密度 b.混合氣體的壓強
c.正反應速率 d.單位時間內,N2和NO的消耗量之比
(2)H2或CO可以催化還原NO以達到消除污染的目的。
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
則H2(g)與NO(g)反應生成N2(g)和H2O(l)的熱化學方程式是。
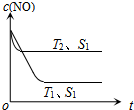
(3)當質量一定時,增大固體催化劑的表面積可提高化學反應速率。如圖表示在其他條件不變時,反應:2NO(g)+2CO(g)?2CO2(g)+N2(g)中NO的濃度[c(NO)]隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線。
①該反應的△H0(填“>”或“<”)。
②若催化劑的表面積S1>S2,在圖中畫出c(NO)在T1、S2條件下達到平衡過程中的變化曲線。組卷:151引用:5難度:0.3


