2015-2016學年河北省保定市高陽中學高二(上)第一次周練化學試卷
發布:2024/4/20 14:35:0
一.選擇題(共7小題,每個小題只有一個正確選項)
-
1.下列反應中生成物總能量高與反應物總能量的是( )
A.碳酸鈣受熱分解 B.乙醇燃燒 C.酸堿中和 D.氧化鈣溶于水 組卷:23引用:4難度:0.7 -
2.已知在1×105Pa、298K條件下,2mol氫氣燃燒生成水蒸氣放出484kJ熱量,下列熱化學方程式正確的是( )
A.H2O(g)=H2(g)+ O2(g);ΔH=+242kJ?mol-112B.2H2(g)+O2(g)═2H2O(l);ΔH=-484kJ?mol-1 C.H2(g)+ O2(g)=H2O(g);ΔH=+242kJ?mol-112D.2H2(g)+O2(g)=2H2O(g);ΔH=-484kJ?mol-1 組卷:313引用:80難度:0.7 -
3.在N2+3H2
2NH3的反應中,在5s中N2由6mol/L減至2mol/L.則NH3的平均反應速率是( )催化劑高溫高壓A.2.4 mol/(L?s) B.1.6mol/(L?s) C.0.8 mol/(L?s) D.0.08 mol/(L?s) 組卷:116引用:10難度:0.9
二.非選擇題(共3小題)
-
9.工業廢水中常含有一定量的Cr2O72-和CrO42-,它們會對人類及生態系統產生很大的傷害,必須進行處理.某工廠使用還原沉淀法處理,該法的工藝流程為:

其中第①步存在平衡:2CrO42-(黃色)+2H+═Cr2O72-(橙色)+H2O
(1)若平衡體系的pH=12,則溶液顯色.
(2)能說明第①步反應達平衡狀態的是.
a.Cr2O72-的濃度不變 b.Cr2O72-和CrO42-的濃度相同
c.2v(Cr2O72-)=v(CrO42-) d.溶液的顏色不變
(3)第②步反應中,還原劑為,該還原劑反應后生成.
(4)電鍍廢液中Cr2O72-還可通過下列反應轉化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l)═2PbCrO4(s)+2H+(aq)△H<0
該反應達平衡后,改變橫坐標表示的反應條件,下列示意圖正確的是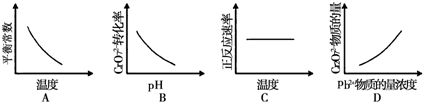 組卷:118引用:2難度:0.5
組卷:118引用:2難度:0.5 -
10.硝酸是一種重要的化工原料,工業上生產硝酸的主要過程如下:
(1)以N2和H2為原料合成氨氣。反應N2(g)+3H2(g)?2NH3(g)ΔH<0
①下列措施可以提高H2的轉化率是(填選項序號)。
a.選擇適當的催化劑 b.增大壓強 c.及時分離生成的NH3 d.升高溫度
②一定溫度下,在密閉容器中充入1molN2和3molH2發生反應。若容器容積恒定,達到平衡狀態時,容器內的壓強是原來的,則N2的轉化率a1=1516;
若容器壓強恒定,達到平衡狀態時,N2的轉化率為a2,則a2a1(填“>”、“<”或“=”)。
(2)以氨氣、空氣為主要原料制硝酸。
①NH3被氧氣催化氧化生成NO的反應的化學方程式是。
②在容積恒定的密閉容器中進行反應2NO(g)+O2(g)?2NO2(g)ΔH>0
該反應的反應速率(v)隨時間(t)變化的關系如圖所示。若t2、t4時刻只改變一個條件,下列說法正確的是(填選項序號)。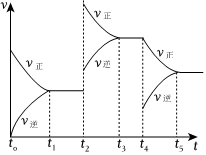
a.在t1~t2時,可依據容器內氣體的壓強保持不變判斷反應已達到平衡狀態
b.在t2時,采取的措施一定是升高溫度
c.在t3~t4時,可依據容器內氣體的密度保持不變判斷反應已達到平衡狀態
d.在t0~t5時,容器內NO2的體積分數在t3時值的最大
③向容積相同、溫度分別為T1和T2的兩個密閉容器中分別充入等量NO2發生反應:
2NO2 (g)?N2O4(g)ΔH<0.恒溫恒容下反應相同時間后,分別測定體系中NO2的百分含量分別為a1,a2.已知T1<T2,則a1a2
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸廠常用如下2種方法處理尾氣。
①催化還原法:催化劑存在時用H2將NO2還原為N2。
已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g)ΔH=+133kJ/mol
則H2還原NO2生成水蒸氣反應的熱化學方程式是。
②堿液吸收法:用Na2CO3溶液吸收NO2生成CO2
若每9.2gNO2和Na2CO3溶液反應時轉移電子數為0.1mol,則反應的離子方程式是。組卷:6引用:2難度:0.5


