2021-2022學年北京市東城區宏志中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題共21小題,每小題2分,共42分。每小題只有一個正確答案。
-
1.當今世界面臨日益加劇的能源危機,下列關于能源的描述不正確的是( )
A.提高燃料的利用效率是解決能源危機的方向 B.正在探索的新能源有太陽能、氫能、風能、海洋能和生物質能等 C.新能源的優點是可以再生、沒有污染或者很少污染 D.燃燒熱是評價燃料優劣的唯一標準 組卷:78引用:13難度:0.9 -
2.下列物質屬于弱電解質的是( )
A.NaCl B.NaOH C.NH3?H2O D.H2SO4 組卷:56引用:8難度:0.6 -
3.下列反應既屬于氧化還原反應,又屬于吸熱反應的是( )
A.鋁片與稀鹽酸反應 B.Ba(OH)2?8H2O與NH4Cl的反應 C.灼熱的碳與CO2的反應 D.甲烷在氧氣中的燃燒反應 組卷:13引用:9難度:0.7 -
4.水溶液中下列電離方程式書寫正確的是( )
A.Ca(OH)2?Ca2++2OH- B.NaHCO3═Na++H++CO32- C.H2CO3?2H++CO32- D.Na2SO4═2Na++SO42- 組卷:23引用:5難度:0.7 -
5.一定條件下,在2L密閉容器中發生反應:A(g)+2B(g)=2C(g)+3D(g),測得5min內,A的物質的量減小了10mol,則5min內該反應的化學反應速率是( )
A.v(A)=1mol/(L?min) B.v(B)=1mol/(L?min) C.v(C)=1mol/(L?min) D.v(D)=1mol/(L?min) 組卷:15引用:2難度:0.6 -
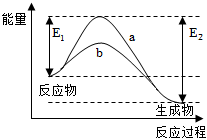 6.如圖表示某可逆反應在使用和未使用催化劑時,反應過程和能量的對應關系。下列說法一定正確的是( )
6.如圖表示某可逆反應在使用和未使用催化劑時,反應過程和能量的對應關系。下列說法一定正確的是( )A.該反應為吸熱反應 B.a與b相比,a的反應速率更快 C.a與b相比,反應的平衡常數一定不同 D.降低溫度有利于該反應向正反應方向進行 組卷:26引用:3難度:0.7 -
7.H2和O2發生反應的過程可用模型圖表示如下(“-”表示化學鍵),下列說法錯誤的是( )
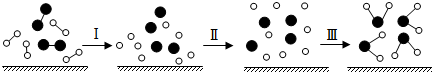
A.過程Ⅰ是吸熱過程 B.過程Ⅲ是放熱過程 C.該反應的能量轉化形式只能以熱能的形式進行 D.該反應過程所有舊化學鍵都斷裂,且形成了新化學鍵 組卷:43引用:3難度:0.6 -
8.N2和H2在催化劑表面合成氨的微觀歷程及能量變化的示意圖如下,用
 、
、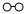 、
、
分別表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1,下列說法正確的是( )
A.使用催化劑導致反應過程發生變化,合成氨反應放出的熱量增大 B.②→③過程,是吸熱過程且只有H-H鍵的斷裂 C.③→④過程,N原子和H原子形成NH3是能量升高的過程 D.合成氨反應中,反應物斷鍵吸收的能量小于生成物形成新鍵釋放的能量 組卷:83引用:4難度:0.5 -
9.痛風病與關節滑液中形成的尿酸鈉(NaUr)有關(NaUr增多,病情加重),其化學原理為:HUr(aq)+Na+ (aq)?NaUr(s)+H+(aq)ΔH<0下列說法不正確的是( )
A.寒冷季節更易誘發關節疼痛 B.大量飲水會增大痛風病發作的可能性 C.飲食中攝入過多食鹽,會加重痛風病病情 D.患痛風病的人應少吃能代謝產生更多尿酸的食物 組卷:403引用:33難度:0.5
二、非選擇題本部分共6題,共58分
-
26.
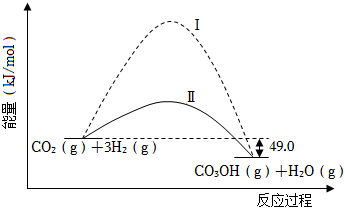 二氧化碳捕獲技術用于去除氣流中的二氧化碳或者分離出二氧化碳作為氣體產物,其中CO2催化合成甲醇是一種很有前景的方法。如圖所示為該反應在無催化劑及有催化劑時的能量變化。
二氧化碳捕獲技術用于去除氣流中的二氧化碳或者分離出二氧化碳作為氣體產物,其中CO2催化合成甲醇是一種很有前景的方法。如圖所示為該反應在無催化劑及有催化劑時的能量變化。
(1)從圖可知,有催化劑存在的是過程。(填“Ⅰ”或“Ⅱ”)
(2)寫出圖中CO2催化合成甲醇的熱化學方程式:。
(3)若要提高上述可逆反應中甲醇的平衡產率,可以采取的措施有。
(4)已知:1mol液態甲醇完全氣化需吸熱37.4kJ,1mol液態水完全汽化需吸熱44.0kJ,由CO2合成1mol液態甲醇和1mol液態水將(填“吸收”或“放出”)kJ熱量。
(5)關于CO2催化合成甲醇的反應,下列說法中,合理的是。(填字母序號)
a.該反應中所有原子都被用于合成甲醇
b.該反應可用于CO2的轉化,有助于緩解溫室效應
c.使用催化劑可以降低該反應的△H,從而使反應放出更多熱量
d.降溫分離出液態甲醇和水,將剩余氣體重新通入反應器,可以提高CO2與H2的利用率組卷:34引用:6難度:0.7 -
27.二甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,總反應的熱化學方程式如下。2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-206.0kJ/mol
工業中采用“一步法”,通過復合催化劑使下列甲醇合成和甲醇脫水反應同時進行:
ⅰ.甲醇合成反應:
ⅱ.甲醇脫水反應:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-24.0kJ/mol
(1)起始時向容器中投入2mol CO和4mol H2,測得某時刻上述總反應中放出的熱量為51.5kJ,此時CO的轉化率為。
(2)請補全甲醇合成反應的熱化學方程式:。
(3)甲醇脫水反應2CH3OH(g)?CH3OCH3(g)+H2O(g)在某溫度下的化學平衡常數為400。此溫度下,在恒容密閉容器中加入一定量的CH3OH(g),測得某時刻各組分濃度如表所示。此時反應(填“已達到”或“未達到”)化學平衡狀態。
(4)生產二甲醚的過程中存在以下副反應,與甲醇脫水反應形成競爭:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H=+48.8kJ/mol。將反應物混合氣按進料比n(CO):n(H2)=1:2通入反應裝置,選擇合適的催化劑。在不同溫度和壓強下,測得二甲醚的選擇性分別如圖1、圖2所示。物質 CH3OH CH3OCH3 H2O 濃度/(mol/L) 0.02 0.4 0.4
資料:二甲醚的選擇性是指轉化為二甲醚的CO在全部CO反應物中所占的比例。
①圖1中,溫度一定,壓強增大,二甲醚選擇性增大的原因是。
②圖2中,溫度高于265℃后,二甲醚選擇性降低的原因有。 組卷:57引用:9難度:0.3
組卷:57引用:9難度:0.3


