魯科版(2019)選擇性必修1《2.4 化學反應條件的優化——工業合成氨》2023年同步練習卷(9)
發布:2024/8/17 5:0:1
一、選擇題
-
1.合成氨廠所需H2可由焦炭與水反應制得,其中有一步反應為CO(g)+H2O(g)═CO2(g)+H2(g)△H<0欲提高CO轉化率,可采用的方法是( )
①降低溫度;②增大壓強;③使用催化劑;④增大CO濃度;⑤增大水蒸氣濃度.A.①②③ B.④⑤ C.①⑤ D.⑤ 組卷:103引用:14難度:0.9 -
2.在容積可變的密閉容器中,2mol N2和8mol H2在一定條件下發生反應,達到平衡時,H2的轉化率為30%,則平衡時氮氣的體積分數為( )
A.12.0% B.14.3% C.19.0% D.66.7% 組卷:7引用:3難度:0.7 -
3.工業上合成氨時一般采用500℃左右的溫度,其原因是( )
①適當提高氨的合成速率
②提高H2的轉化率
③提高氨的產量
④催化劑在500℃時的活性最大A.只有④ B.①② C.①③④ D.①④ 組卷:42引用:4難度:0.8 -
4.CO和NO都是汽車尾氣中的有害物質,它們之間能緩慢地發生如下反應:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,現利用此反應,擬設計一種環保裝置,用來消除汽車尾氣對大氣的污染,下列設計方案可以提高尾氣處理效果的是( )
①選用適當的催化劑 ②提高裝置溫度 ③降低裝置的壓強 ④裝置中放入堿石灰.A.①③ B.②④ C.①④ D.②③ 組卷:31引用:12難度:0.9 -
5.常壓下羰基化法精煉鎳的原理為:Ni(s)+4CO(g)═Ni(CO)4(g)△H<0 230℃時,該反應的平衡常數K=2×10-5.已知:Ni(CO)4的沸點為42.2℃,固體雜質不參與反應。
第一階段:將粗鎳與CO反應轉化成氣態Ni(CO)4;
第二階段:將第一階段反應后的氣體分離出來,加熱至230℃制得高純鎳。
下列判斷錯誤的是( )A.第一階段,選擇反應溫度應高于42.2℃ B.第一階段增加c(CO),平衡向正向移動,反應的平衡常數不變 C.第二階段,Ni(CO)4幾乎完全分解 D.第二階段,及時分離出Ni,有利于平衡移動 組卷:29引用:4難度:0.7
二、解答題
-
 15.科學家一直致力于研究常溫、常壓下“人工固氮”的新方法.曾有實驗報道:在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生反應,生成的主要產物為NH3.進一步研究NH3生成量與溫度的關系,部分實驗數據見下表(光照、N2、壓強1.0×105 Pa、反應時間3h):
15.科學家一直致力于研究常溫、常壓下“人工固氮”的新方法.曾有實驗報道:在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生反應,生成的主要產物為NH3.進一步研究NH3生成量與溫度的關系,部分實驗數據見下表(光照、N2、壓強1.0×105 Pa、反應時間3h):
相應的熱化學方程式如下:N2(g)+3H2O(l)?2NH3(g)+T/K 303 313 323 353 NH3生成量
/10-6 mol4.8 5.9 6.0 2.0 O2(g)△H=+765.2kJ?mol-132
回答下列問題:
(1)請畫出上述反應在有催化劑與無催化劑兩種情況下反應過程中體系能量變化的示意圖,并進行必要標注.
(2)與目前廣泛使用的工業合成氨方法相比,該方法固氮反應速率慢.請提出可提高其反應速率且增大NH3生成量的建議:(寫兩點);.
(3)工業合成氨的反應為N2(g)+3H2(g)高溫、高壓催化劑
2NH3(g).設在容積為2.0L的密閉容器中充入0.60mol N2(g)和1.60mol H2(g),反應在一定條件下達到平衡時,NH3的物質的量分數(NH3的物質的量與反應體系中總的物質的量之比)為.47
計算:①該條件下N2的平衡轉化率為(保留一位小數).
②該條件下反應2NH3(g)高溫、高壓催化劑N2(g)+3H2(g)的平衡常數.
③若反應溫度不變,假如在容積為2.0L的密閉容器中起始充入0.40mol N2(g)和0.40mol H2(g),反應3min時測得體系壓強為原來的,這段時間H2的平均反應速率為34.組卷:12引用:2難度:0.5 -
 16.合成氨技術的創立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數K值和溫度的關系如下:
16.合成氨技術的創立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數K值和溫度的關系如下:
(1)①寫出工業合成氨的化學方程式溫 度(℃) 360 440 520 K值 0.036 0.010 0.0038 .
②由上表數據可知該反應為放熱反應,理由是.
③理論上,為了增大平衡時H2的轉化率,可采取的措施是.(填序號)
a.增大壓強 b.使用合適的催化劑
c.升高溫度 d.及時分離出產物中的NH3
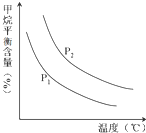
(2)原料氣H2可通過反應 CH4(g)+H2O (g)═CO(g)+3H2(g) 獲取,已知該反應中,當初始混合氣中的恒定時,溫度、壓強對平衡混合氣CH4含量的影響如圖所示:n(H2O)n(CH4)
①圖中,兩條曲線表示壓強的關系是:P1P2(填“>”、“=”或“<”).
②該反應為反應(填“吸熱”或“放熱”).
(3)原料氣H2還可通過反應CO(g)+H2O(g)═CO2 (g)+H2(g) 獲取.
①T℃時,向容積固定為5L的容器中充入1mol水蒸氣和1mol CO,反應達平衡后,測得CO的濃度為0.08mol?L-1,則平衡時CO的轉化率為,該反應平衡常數的表達式為.
②保持溫度仍為T℃,改變水蒸氣和CO的初始物質的量之比,充入容器進行反應,下列描述能夠說明體系處于平衡狀態的是(填序號).
a.容器內壓強不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內生成a mol CO2的同時消耗a mol H2
d.混合氣中n (CO):n (H2O):n (CO2):n (H2)=1:1:1:1.組卷:8引用:3難度:0.3


