2021-2022學年浙江省衢州市常山縣育才中學九年級(上)期中科學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共15小題,1-10小題每題3分,11-15小題每題2分,共40分,每小題只有一個選項是正確的,不選、多選、錯選均不得分)
-
1.“一帶一路”是跨越時空的宏偉構想,賦予古絲綢之路嶄新的時代內涵,古絲綢之路將中國的發明和技術傳送到國外,下列不屬于化學變化的是( )
A.蠶絲織綾 B.使用火藥 C.冶煉金屬 D.酒曲釀酒 組卷:2引用:1難度:0.5 -
2.下列數據為常見水果的pH,其中酸性最強的是( )
A. 
檸檬pH(2~3)B. 
橙子pH(3~4)C. 
西紅柿pH(4~5)D. 
西瓜pH(5~6)組卷:2引用:3難度:0.5 -
3.衣服上沾了鐵銹(主要成分是Fe2O3),直接用水很難洗凈,要除去白色襯衣上的鐵銹,你認為比較適宜的液體是( )
A.白醋 B.醬油 C.酒精 D.洗潔精 組卷:11引用:6難度:0.8 -
4.下列實驗操作正確的是( )
A. 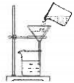 過濾
過濾B.  稱取氫氧化鈉固體
稱取氫氧化鈉固體C. 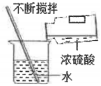 稀釋濃硫酸
稀釋濃硫酸D. 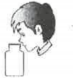 聞氣體氣味組卷:5引用:1難度:0.5
聞氣體氣味組卷:5引用:1難度:0.5 -
5.中和反應在工農業生產和日常生活中有廣泛的用途,下列應用與中和反應無關的是( )
A.施用熟石灰改良酸性土壤 B.服用含有Al(OH)3的藥物治療胃酸過多 C.用熟石灰和硫酸銅配制波爾多液 D.用NaOH溶液洗滌石油產品中的殘余硫酸 組卷:6引用:1難度:0.5 -
6.物質存放在燒杯中一段時間后,質量變大且變質的是( )
①濃鹽酸 ②濃硫酸 ③燒堿 ④食鹽 ⑤生石灰 ⑥稀硫酸。A.①⑥ B.②③⑤ C.③⑤ D.②③④ 組卷:16引用:3難度:0.5 -
7.固體酒精也被稱為“固體燃料塊”,因使用、運輸和攜帶方便而廣泛應用于餐飲業和旅游業。其主要成分是乙醇,化學式為CH3CH2OH。關于乙醇,下列說法錯誤的是( )
A.乙醇是有機物 B.乙醇中碳元素的質量分數為52.2% C.乙醇中各元素的質量比C:H:O=12:3:8 D.乙醇分子由2個碳原子、6個氫原子和1個氧原子構成 組卷:1引用:1難度:0.5 -
8.為提純下列物質,所選用的除雜試劑和分離方法都正確的是( )
選項 物質(括號內為雜質) 除雜試劑 分離方法 A 氯化鈉固體(碳酸鈉) 稀鹽酸 蒸發結晶 B 氯化銅溶液(氯化鋅) 金屬銅 過濾 C 二氧化碳(一氧化碳) 空氣 點燃 D 二氧化錳粉末(碳粉) 水 過濾 A.A B.B C.C D.D 組卷:5引用:1難度:0.5 -
9.下列操作可能導致原溶液pH減小的是( )
A.向稀鹽酸中加入硝酸銀溶液 B.向稀鹽酸中加入石灰石 C.向稀硫酸中加入氫氧化鈉溶液 D.向氫氧化鈉溶液中加入氯化鈉溶液 組卷:2引用:1難度:0.5 -
10.英國化學家亨利?卡文迪許是燃素說的信仰者。1766年,他用鐵、鋅、錫等六種金屬與稀硫酸、稀鹽酸作用制得“可燃空氣”。并將其表示為:

用所學化學知識判斷。下列說法正確的是( )A.“可燃空氣”是從金屬中分解出來的 B.上述六種金屬包括銅 C.“可燃空氣”可以用排水集氣法收集 D.上述反應屬于復分解反應 組卷:3引用:3難度:0.5 -
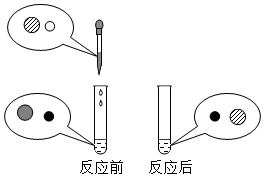 11.向氫氧化鈉溶液中滴加稀鹽酸至恰好完全反應,反應前后溶液中存在的離子種類如圖所示(其中“〇”“
11.向氫氧化鈉溶液中滴加稀鹽酸至恰好完全反應,反應前后溶液中存在的離子種類如圖所示(其中“〇”“ ”“
”“ ”“
”“ ”表示不同離子)。下列說法正確的是( )
”表示不同離子)。下列說法正確的是( )A.〇表示陰離子 B.  表示陽離子
表示陽離子C.此反應中  和〇的種類和數量保持不變
和〇的種類和數量保持不變D.  可用適量硝酸銀溶液和足量稀硝酸進行檢測組卷:7引用:2難度:0.5
可用適量硝酸銀溶液和足量稀硝酸進行檢測組卷:7引用:2難度:0.5
三、探究題(本題有5小題,24-25題每空3分,26-28題每空2分,共36分)
-
34.某地規定:工業排放的氣中SO2的含量不超過0.4mg?L-1,某興趣小組利用反應SO2+I2+2H2O=H2SO4+2HI,測定某工業廢氣中SO2的含量,測試裝置如圖所示。
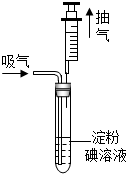
測試步驟:
①碘溶液的配制:準確稱取1.27g碘單質,加入少量碘化鉀,先溶解在100mL水中,續加水配制成1000mL溶液。
②取5mL上述溶液,加入試管中,滴入2~3滴淀粉試液,溶液變藍。
③把100mL注射器的活塞推到底后,插入試管的橡皮塞中,如圖所示。然后緩緩向外拉注射器,每次抽取的氣體為100mL,重復抽取n次,直到溶液變為無色(廢氣中的其它成分不與淀粉碘溶液反應)。
(1)步驟②中,5mL溶液中溶有碘單質mg,步驟③中緩緩向外拉注射器,“緩緩”的目的是,
(2)按步驟測試某工業廢氣,抽取次數為80次后,溶液剛好變為無色,試計算該廢氣中SO2含量,并判斷是否符合排放標準。組卷:5引用:1難度:0.5 -
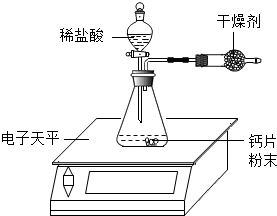 35.小明為了測定某鈣片中碳酸鈣的質量分數,用如圖裝置進行如下實驗:
35.小明為了測定某鈣片中碳酸鈣的質量分數,用如圖裝置進行如下實驗:
①取研碎后的鈣片4克,導入氣密性良好的錐形瓶中,然后在分液漏斗中加入適量的稀鹽酸,置于電子天平上測出裝置總質量。
②打開活塞,滴入足量稀鹽酸后關閉活塞,待氣泡不再冒出時,測出反應后裝置總質量。
③整理相關數據如表所示,計算出鈣片中碳酸鈣的質量分數。
1)該實驗中,對裝置中的固態干燥劑的性質有何要求?反應前總質量(克) 275.58 反應后總質量(克) 274.92 反應前后總質量差(克) 0.66 容器內氣體質量差(克) m
(2)反應前容器內是空氣(密度為ρ1),反應后全部是二氧化碳(密度為ρ2),則反應前后容器(容積為V)內的氣體質量差為m為。(用字母表示,反應物的體積忽略不計)
(3)小明查閱有關數據后,計算出反應前后容器內的氣體質量差m為0.22克,結合表中數據,計算該鈣片中碳酸鈣的質量分數。(CaCO3+2HCl=CaCl2+H2O+CO2↑)。鈣片中的其它成分不與鹽酸反應。組卷:25引用:3難度:0.5


