2021-2022學年黑龍江省牡丹江一中高二(下)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共15小題,每小題4分,共60分,每小題只有一個選項符合題意)
-
1.下列各原子或離子的電子排布式錯誤的是( )
A.Na+:1s22s22p6 B.F:1s22s22p5 C.Cl-:1s22s22p63s23p5 D.Mn:1s22s22p63s23p63d54s2 組卷:23引用:4難度:0.7 -
2.下列事實不能用勒夏特列原理解釋的是( )
A.工業合成氨時,適當提高N2濃度,以提高H2的轉化率 B.對平衡體系2NO2?N2O4(g),縮小容器的體積,混合氣體的顏色突然加深 C.實驗室可用排飽和NaCl溶液的方法收集Cl2 D.用稀鹽酸洗滌AgCl沉淀比用等體積的蒸餾水洗滌損失的AgCl少 組卷:15引用:3難度:0.7 -
3.已知在CuCl2水溶液中存在如下平衡:Cu(H2O)42+(藍色)+4Cl-?CuCl42-(黃色)+4H2O?ΔH>0,下列可以使黃綠色的CuCl2水溶液顏色變藍的實驗操作是( )
A.加入適量NaCl固體 B.加入適量AgNO3溶液 C.給溶液加熱 D.加入合適的催化劑 組卷:57引用:6難度:0.5 -
4.下列實驗不能達到預期目的的是( )
編號 實驗內容 實驗目的 A 室溫下,用pH試紙測定濃度均為0.1mol?L-1NaClO溶液和CH3COONa溶液的pH 比較HClO和CH3COOH的酸性強弱 B 向含有酚酞的Na2CO3溶液中加入少量BaCl2固體,溶液紅色變淺 證明Na2CO3溶液中存在水解平衡 C 等體積等pH的HX和HY兩種酸分別與足量的鋅反應,HX放出的氫氣多且反應速率快 證明HX酸性比HY弱 D 把兩只裝有NO2和N2O4混合氣體的連通燒瓶,一只放冷水里,一只放熱水里,觀察顏色變化 探究溫度對化學平衡的影響 A.A B.B C.C D.D 組卷:27引用:3難度:0.5 -
5.下列原理的應用及離子方程式書寫均正確的是( )
A.用TiCl4水解制備TiO2?xH2O(加大量水并加熱):TiCl4+2H2O═TiO2↓+4HCl B.泡沫滅火器原理:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ C.鋼鐵發生吸氧腐蝕的正極反應:O2+2H2O+4e-═4OH- D.用鐵電極電解MgCl2溶液:Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑電解組卷:20引用:1難度:0.8
二、解答題(共2小題,滿分40分)
-
16.鉻酸鹽是指含鉻酸根(CrO42-)的鹽類。鉻酸鹽最顯著的特點是具有鮮明的顏色,如BaCrO4呈黃色,Ag2CrO4呈磚紅色。
I、工業廢水中常含有一定量的CrO72-和CrO42-,它們會對人類及生態系統產生很大的傷害,必須進行處理。還原沉淀法是常用的處理方法之一,工藝流程如下:CrO42-Cr2O72-H+①轉化Cr3+Fe2+②還原Cr(OH)3。OH-③沉淀
(1)第①步中,轉化反應的離子方程式為:,該體系pH=2時,溶液呈色。
(2)第③步中,要使Cr3+沉淀完全,應調整溶液的pH≥。(已知常溫下,Ksp[Cr(OH)3]=1.0×10-32)
II、莫爾法是用K2CrO4作指示劑,用AgNO3作標準溶液的測定Cl-(或Br-)的方法。現用莫爾法測定亞硝酰氯樣品中NOCl的純度,實驗步驟如下:
步驟1:取mgNOCl樣品,溶于蒸餾水(發生反應:NOCl+H2O═HNO2+HCl),配制成250mL溶液,準確量取25.00mL溶液于錐形瓶中:
步驟2:加入適量K2CrO4溶液作指示劑,用cmol?L-1AgNO3標準溶液滴定至終點,消耗標準溶液的體積為VmL;
(3)滴定終點的標志是。
(4)亞硝酰氯樣品中NOCl的純度為。
(5)若滴定終點時俯視讀數,所測NOCl的純度(填“偏高”、“偏低”、“不變”)。組卷:6引用:3難度:0.6 -
17.電化學原理在防止金屬腐蝕、能量轉換、物質合成等方面應用廣泛。
(1)圖1中,為了減緩海水對鋼閘門A的腐蝕,材料B可以選擇(填字母)。
a.碳棒
b.鋅板
c.銅板
d.鋁鎂合金
這種電化學防腐方法稱為。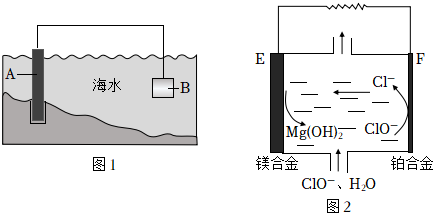
(2)鎂燃料電池在可移動電子設備電源和備用電源等方面應用前景廣闊。圖2為“鎂-次氯酸鹽”燃料電池原理示意圖,電極為鎂合金和鉑合金。
①E為該燃料電池的極,F電極上的電極反應式為。
②常溫下,若用該燃料電池電解500mL飽和食鹽水,當產生標準狀況下1120mL氣體時,溶液的pH為。(忽略電解前后溶液體積的變化)
③燃料電池應用前景廣闊,主要優點有(答出兩點即可)。組卷:15引用:3難度:0.4


