2021-2022學年四川省成都市樹德中學高二(下)段考化學試卷(4月份)
發布:2024/8/6 8:0:9
一、選擇題(每小題只有一個選項符合題意,每小題3分,共48分)
-
1.化學與生活密切相關,下列說法錯誤的是( )
A.疫苗一般應冷藏存放,以避免蛋白質變性 B.北京冬奧會使用氫燃料電池汽車有利于實現碳達峰和碳中和 C.泡沫滅火器可用于一般的起火,也適用于電器起火 D.電熱水器用鎂棒防止內膽腐蝕,原理是犧牲陽極的陰極保護法 組卷:18引用:2難度:0.8 -
2.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.100g質量分數為 46%C2H5OH溶液中所含O-H數目約為7NA B.質量為12g的12C含有的中子數為12NA C.將0.1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-數目小于0.1NA D.氫氧燃料電池正極消耗22.4 L氣體時,電路中通過的電子數目為4NA 組卷:14引用:2難度:0.6 -
3.下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6種元素的代號。其中J為0族元素。
下列說法正確的是( )X Y Z R W J A.基態R原子的軌道表示式為 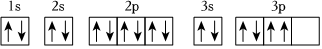
B.Y2-與Na+的半徑大小關系為Y2->Na+ C.Y元素的第一電離能大于X元素的第一電離能 D.電負性最大的元素為J 組卷:31引用:6難度:0.5 -
4.具有下列電子層結構的原子:①3p軌道上只有一對成對電子的原子;②最外層電子排布式為2s22p5的原子;③其3p軌道為半充滿狀態的原子;④+3價的陽離子結構與氖相同的原子。則下列有關比較正確的是( )
A.第一電離能:②>③>①>④ B.原子半徑:④>③>②>① C.電負性:②>③>①>④ D.最高化合價:②>①>③>④ 組卷:6引用:1難度:0.7 -
5.ClO2和NaClO2均具有漂白性,工業上用ClO2氣體制NaClO2的工藝流程如圖所示。

下列說法不正確的是( )A.步驟a的操作包括過濾、洗滌和干燥 B.吸收器中生成NaClO2的離子方程式:2ClO2+H2O2═2 +O2↑+2H+ClO-2C.工業上可將ClO2制成NaClO2固體,便于貯存和運輸 D.通入空氣的目的是驅趕出ClO2,使其被吸收器充分吸收 組卷:181引用:9難度:0.7 -
 6.探索二氧化碳在海洋中轉移和歸宿,是當今海洋科學研究的前沿領域。研究表明,溶于海水的二氧化碳主要以無機碳形式存在,其中HCO3-占95%。科學家利用下圖所示裝置從海水中提取CO2,有利于減少環境溫室氣體含量。下列說法不正確的是( )
6.探索二氧化碳在海洋中轉移和歸宿,是當今海洋科學研究的前沿領域。研究表明,溶于海水的二氧化碳主要以無機碳形式存在,其中HCO3-占95%。科學家利用下圖所示裝置從海水中提取CO2,有利于減少環境溫室氣體含量。下列說法不正確的是( )A.a室中OH-在電極板上被氧化 B.b室發生反應的離子方程式為:H++HCO3-═CO2↑+H2O C.電路中每有0.2mol 電子通過時,就有0.2mol陽離子從c室移至b室 D.若用氫氧燃料電池供電,則電池負極可能發生的反應為:H2+2OH--2e-═2H2O 組卷:7引用:3難度:0.5
二、填空題(共52分)
-
19.溫室氣體的利用是當前環境和能源領域的研究熱點。
Ⅰ.CH4與CO2重整可以同時利用兩種溫室氣體,其工藝過程中涉及如下反應:
反應①CH4(g)+CO2(g)?2CO(g)+2H2(g) ΔH1
反應②CO2(g)+H2(g)?CO(g)+H2O(g) ΔH2=+41.2kJ?mol-1
反應③CH4(g)+O2(g)?CO(g)+2H2(g) ΔH3=-35.6kJ?mol-112
(1)已知:O2(g)+H2(g)?H2O(g) ΔH=-241.8kJ?mol-1,則ΔH1=12kJ?mol-1。
(2)一定條件下,向體積為VL的密閉容器中通入CH4、CO2各1.0mol及少量O2,測得不同溫度下反應平衡時各產物產量如圖一所示。
①圖中a和b分別代表產物和。
②1100K時,CH4與CO2的轉化率分別為95%和90%,反應①的平衡常數K=(寫出計算式)。
Ⅱ.Ni-CeO2催化CO2加H2形成CH4的反應歷程如圖二所示(吸附在催化劑表面的物種用*標注),含碳產物中CH4的物質的量百分數(Y)及CO2的轉化率隨溫度的變化如圖三所示。
(3)下列對CO2甲烷化反應體系的說法不合理的有。
A.含碳副產物的產率均低于CH4
B.存在反應CO2+4H2?CH4+2H2O
C.存在副反應CO2+H2?CO+H2O
D.CO2轉化為CH4的過程中未發生能量轉化
(4)CO2甲烷化的過程中,保持CO2與H2的體積比為1:4,反應氣的總流量控制在40mL?min-1,320℃時測得CO2轉化率為80%,則CO2反應速率為mL?min-1。組卷:25引用:1難度:0.5 -
20.硫酰氯(SO2Cl2)和亞硫酰氯(SOCl2)都是重要的化工試劑,均易水解。
(1)甲同學在實驗室利用SO2和Cl2在活性炭催化作用下制取SO2Cl2,裝置如圖所示
①B裝置中冷凝管進水口是。(填“m”或“n”),B中干燥管盛有的物質是。
②欲制取少量SO2Cl2,選擇上圖中的裝置(可以重復選用),其連接順序為:a、、h。
③去除C裝置會降低SO2和Cl2的利用率,可能的原因是(用化學方程式表示)。
(2)SOCl2水解后無殘留物,較SO2Cl2是更好的脫水劑。乙同學設計實驗利用SOCl2和 ZnCl2?xH2O制取無水ZnCl2。
①解釋SOCl2在該實驗中的作用是(寫出兩點)。
②實驗室常用NaOH溶液吸收SOCl2,該反應的離子方程式是。
(3)乙同學認為SOCl2還可用作由FeCl3?6H2O制取無水FeCl3的脫水劑,但丙同學認為該實驗可能發生副反應使產品不純。
①可能發生的副反應的化學方程式是。
②兩同學設計如下實驗判斷副反應的可能性:取少量SOCl2和FeCl3?6H2O反應后的混合物于試管中,加水溶解,將溶液平分至五支試管,分別進行以下實驗,其中能得出合理結論的是。
A.加入過量稀HNO3,再滴加幾滴AgNO3溶液
B.加入少量稀HNO3,再滴加幾滴BaCl2溶液
C.滴加幾滴BaCl2溶液
D.滴加幾滴酸性KMnO4溶液
E.滴加幾滴KSCN溶液后,再滴加幾滴氯水組卷:277引用:5難度:0.7


