2021-2022學(xué)年天津市塘沽一中高三(上)開學(xué)化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.新冠病毒由蛋白質(zhì)外殼和單鏈核酸組成,分子平均直徑為60~140nm。下列有關(guān)新冠病毒的說法錯(cuò)誤的是( )
A.該病毒由C、H、O三種元素組成 B.新冠病毒在空氣中可以“氣溶膠”形式傳播 C.過氧乙酸、75%的乙醇、“84”消毒液等均可有效滅活新冠病毒 D.我國(guó)研制的重組新冠病毒疫苗應(yīng)避光、冷藏保存 組卷:46引用:4難度:0.8 -
2.化學(xué)用語(yǔ)的書寫和使用應(yīng)符合規(guī)范要求。下列化學(xué)用語(yǔ)不正確的是( )
A.Cl-的結(jié)構(gòu)示意圖: 
B.羥基的電子式: 
C.重水的分子式:H218O D.HClO的結(jié)構(gòu)式:H-O-Cl 組卷:10引用:1難度:0.7 -
3.下列離子方程式書寫正確的是( )
A.Na2S2O3溶液與稀H2SO4反應(yīng)的離子方程式:S2O32-+6H+═2S↓+3H2O B.Fe與稀硝酸反應(yīng),當(dāng)n(Fe):n(HNO3)=1:2時(shí),3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O C.向飽和Na2CO3溶液中通入過量CO2,CO32-+CO2+H2O═2HCO3- D.AgNO3溶液與過量濃氨水反應(yīng)的離子方程式:Ag++NH3?H2O═AgOH↓+NH4+ 組卷:34引用:1難度:0.5 -
4.在給定條件下,下列物質(zhì)轉(zhuǎn)化每一步都能實(shí)現(xiàn)的是( )
A.NaCl(aq) Cl2(g)電解漂白粉(s)石灰乳B.Mg(OH)2 MgCl2(aq)鹽酸Mg電解C.Fe3O4(s) Fe(s)Al(s)高溫FeCl2(s)Cl2(g)△D.CuSO4(aq) Cu(OH)2(s)過量氨水Cu2O葡萄糖△組卷:23引用:3難度:0.7 -
 5.屠呦呦因發(fā)現(xiàn)治療瘧疾的青蒿素和雙氫青蒿素(結(jié)構(gòu)如圖)獲得諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)。一定條件下青蒿素可以轉(zhuǎn)化為雙氫青蒿素。下列有關(guān)說法不正確的是( )
5.屠呦呦因發(fā)現(xiàn)治療瘧疾的青蒿素和雙氫青蒿素(結(jié)構(gòu)如圖)獲得諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)。一定條件下青蒿素可以轉(zhuǎn)化為雙氫青蒿素。下列有關(guān)說法不正確的是( )A.雙氫青蒿素治療瘧疾的效果比青蒿素好,是因?yàn)殡p氫青蒿素的水溶性更好 B.青蒿素轉(zhuǎn)化為雙氫青蒿素發(fā)生了還原反應(yīng) C.青蒿素和雙氫青蒿素均能和NaI溶液發(fā)生反應(yīng) D.青蒿素和雙氫青蒿素在堿性條件下均能發(fā)生水解反應(yīng) 組卷:12引用:1難度:0.5
二、解答題(共4小題,滿分64分)
-
15.為測(cè)定CuSO4溶液的濃度,甲、乙兩同學(xué)設(shè)計(jì)了兩個(gè)方案。回答下列問題:
Ⅰ.甲方案
實(shí)驗(yàn)原理:CuSO4+BaCl2═BaSO4↓+CuCl2
實(shí)驗(yàn)步驟: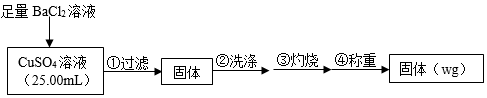
(1)判斷沉淀完全的操作為SO2-4。
(2)步驟②判斷沉淀是否洗凈所選用的試劑為。
(3)步驟③灼燒時(shí)盛裝樣品的儀器名稱為。
(4)固體質(zhì)量為wg,則c(CuSO4)=mol?L-1。
(5)若步驟①?gòu)臒修D(zhuǎn)移沉淀時(shí)未洗滌燒杯,則測(cè)得c(CuSO4)(填“偏高”、“偏低”或“無影響”)。
Ⅱ.乙方案
實(shí)驗(yàn)原理:Zn+CuSO4═ZnSO4+Cu
Zn+H2SO4═ZnSO4+H2↑
實(shí)驗(yàn)步驟:
①按如圖安裝裝置(夾持儀器略去)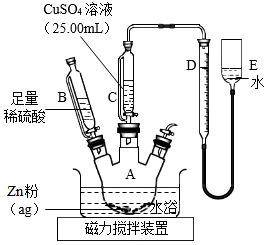
②……
③在儀器A、B、C、D、E中加入如圖所示的試劑
④調(diào)整D、E中兩液面相平,使D中液面保持在0或略低于0刻度位置,讀數(shù)并記錄
⑤將CuSO4溶液滴入A中并攪拌,反應(yīng)完成后,再滴加稀硫酸至體系不再有氣體產(chǎn)生
⑥待體系恢復(fù)到室溫,移動(dòng)E管,保持D、E中兩液面相平,讀數(shù)并記錄
⑦處理數(shù)據(jù)
(6)步驟②為。
(7)步驟⑥需保證體系恢復(fù)到室溫的原因是(填序號(hào))。
a.反應(yīng)熱受溫度影響
b.氣體密度受溫度影響
c.反應(yīng)速率受溫度影響
(8)Zn粉質(zhì)量為ag,若測(cè)得H2體積為bmL,已知實(shí)驗(yàn)條件下ρ(H2)=dg?L-1,則c(CuSO4)=mol?L-1(列出計(jì)算表達(dá)式)。
(9)若步驟⑥E管液面高于D管,未調(diào)液面即讀數(shù),則測(cè)得c(CuSO4)(填“偏高”、“偏低”或“無影響”)。
(10)是否能用同樣的裝置和方法測(cè)定MgSO4溶液的濃度:(填“是”或“否”)。組卷:828引用:6難度:0.5 -
16.(1)科學(xué)家利用電化學(xué)裝置實(shí)現(xiàn)CH4和CO2兩種分子的耦合轉(zhuǎn)化來達(dá)到減碳的目的,其原理如圖所示:

①電極A上的電極反應(yīng)式為。
②若生成的乙烯和乙烷的體積比為2:1,則消耗的CH4和CO2體積比為。
(2)CO2一定條件可轉(zhuǎn)化為CH3OH:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0。
①下列有關(guān)該反應(yīng)的說法正確的是(填序號(hào))。
A.升高溫度逆反應(yīng)速率加快,正反應(yīng)速率減慢
B.反應(yīng)體系中CH3OH濃度不再變化,說明反應(yīng)達(dá)到平衡狀態(tài)
C.恒溫恒容下達(dá)到平衡后,再通入N2,平衡向正反應(yīng)方向移動(dòng)
D.平衡時(shí),若改變體積增大壓強(qiáng),則c(CO2)、c(CH3OH)均變大
②某溫度下恒容密閉容器中,CO2和H2起始濃度分別為amol?L-1和3amol?L-1,反應(yīng)達(dá)平衡時(shí),CO2轉(zhuǎn)化率為b,該溫度下反應(yīng)的平衡常數(shù)K=。
(3)工業(yè)上用氫氧化鈉溶液來同時(shí)吸收SO2和氮的氧化物氣體(NOx),可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。(已知:常溫下,HNO2的電離常數(shù)為Ka=7×10-4,H2SO3的電離常數(shù)為Ka1=1.2×10-2、Ka2=5.8×10-8)。
①常溫下,相同濃度的Na2SO3、NaNO2溶液中pH較大的是溶液。
②常溫下,NaHSO3溶液顯性(填“酸”“堿”或“中”),判斷的理由是(通過計(jì)算說明)。組卷:25引用:1難度:0.5


