蘇教版必修2高考題同步試卷:1.1 原子核外電子排布與周期律(01)
發(fā)布:2024/4/20 14:35:0
一、選擇題(共25小題)
-
1.不能作為判斷硫、氯兩種元素非金屬性強(qiáng)弱的依據(jù)是( )
A.單質(zhì)氧化性的強(qiáng)弱 B.單質(zhì)沸點(diǎn)的高低 C.單質(zhì)與氫氣化合的難易 D.最高價(jià)氧化物對(duì)應(yīng)的水化物酸性的強(qiáng)弱 組卷:1977引用:36難度:0.9 -
2.下列有關(guān)性質(zhì)的比較,不能用元素周期律解釋的是( )
A.熱穩(wěn)定性:Na2CO3>NaHCO3 B.非金屬性:Cl>Br C.堿性:NaOH>Mg(OH)2 D.酸性:H2SO4>H3PO4 組卷:228引用:118難度:0.7 -
3.下列離子中半徑最大的是( )
A.Na+ B.Mg2+ C.O2- D.F- 組卷:1975引用:53難度:0.9 -
4.短周期元素甲、乙、丙、丁的原子序數(shù)依次增大,甲和丁的原子核外均有兩個(gè)未成對(duì)電子,乙、丙、丁最高價(jià)氧化物對(duì)應(yīng)的水化物兩兩之間能相互反應(yīng).下列說(shuō)法錯(cuò)誤的是( )
A.元素丙的單質(zhì)可用于冶煉金屬 B.甲與丁形成的分子中有非極性分子 C.簡(jiǎn)單離子半徑:丁>乙>丙 D.甲與乙形成的化合物均有氧化性 組卷:645引用:18難度:0.9 -
5.如表為元素周期表的一部分,其中X、Y、Z、W為短周期元素,W元素原子的核電荷數(shù)為X元素的2倍。下列說(shuō)法正確的是( )
X Y Z W T A.X、W、Z元素的原子半徑及它們的氣態(tài)氫化物的熱穩(wěn)定性均依次遞增 B.Y、Z、W元素在自然界中均不能以游離態(tài)存在,它們的最高價(jià)氧化物的水化物的酸性依次遞增 C.YX2晶體熔化、液態(tài)WX3氣化均需克服分子間作用力 D.根據(jù)元素周期律,可以推測(cè)T元素的單質(zhì)具有半導(dǎo)體特性,T2X3具有氧化性和還原性 組卷:3238引用:46難度:0.5 -
6.甲~庚等元素在周期表中的相對(duì)位置如圖,己的最高價(jià)氧化物對(duì)應(yīng)水化物有強(qiáng)脫水性,甲和丁在同一周期,甲原子最外層與最內(nèi)層具有相同電子數(shù),下列判斷正確的是( )
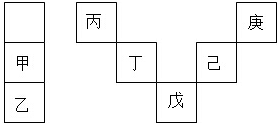
A.丙與戊的原子序數(shù)相差28 B.氣態(tài)氫化物的穩(wěn)定性:庚<己<戊 C.常溫下,甲和乙的單質(zhì)均能與水劇烈反應(yīng) D.丁的最高價(jià)氧化物可用于制造光導(dǎo)纖維 組卷:1954引用:23難度:0.7 -
7.下列四種元素中,其單質(zhì)氧化性最強(qiáng)的是( )
A.原子含有未成對(duì)電子最多的第二周期元素 B.位于周期表中第三周期ⅢA族的元素 C.原子最外電子層排布為2s22p6的元素 D.原子最外電子層排布為3s23P5的元素 組卷:222引用:23難度:0.9 -
8.下列分子中所有原子都滿足最外層為8電子結(jié)構(gòu)的是( )
A.SiCl4 B.H2O C.BF3 D.PCl5 組卷:94引用:87難度:0.9 -
9.下列有關(guān)物質(zhì)性質(zhì)的說(shuō)法錯(cuò)誤的是( )
A.熱穩(wěn)定性:HCl>HI B.原子半徑:Na>Mg C.酸性:H2SO3>H2SO4 D.結(jié)合質(zhì)子能力:S2->Cl- 組卷:1779引用:33難度:0.9 -
10.重水(D2O)是重要的核工業(yè)原料,下列說(shuō)法錯(cuò)誤的是( )
A.氘(D)原子核外有1個(gè)電子 B.1H與D互稱同位素 C.H2O與D2O互稱同素異形體 D.1 O與H182O的相對(duì)分子質(zhì)量相同D162組卷:1232引用:101難度:0.9
三、解答題(共4小題)
-
29.X,Z,Q,R,T,U分別代表原子序數(shù)依次增大的短周期元素;X和R屬同族元素,Z和U位于第ⅦA族;X和Z可形成化合物XZ4;Q基態(tài)原子的s軌道和P軌道的電子總數(shù)相等:T的一種單質(zhì)在空氣中能夠自燃.
請(qǐng)回答下列問(wèn)題:
(1)R基態(tài)原子的電子排布式是.
(2)利用價(jià)層電子對(duì)互斥理論判斷TU3的立體構(gòu)型是.
(3)x所在周期元素最高價(jià)氧化物對(duì)應(yīng)的水化物中.酸性最強(qiáng)的是(填化學(xué)式);Z和U的氫化物中沸點(diǎn)較高的是(填化學(xué)式);Q,R,U的單質(zhì)形成的晶體,熔點(diǎn)由高到低的排列順序是(填化學(xué)式)
(4)CuSO4溶液能用作T4中毒的解毒劑,反應(yīng)可生成T的最高價(jià)含氧酸和銅,該反應(yīng)的化學(xué)方程式是.組卷:1070引用:21難度:0.5 -
30.元素單質(zhì)及其化合物有廣泛用途,請(qǐng)根據(jù)周期表中第三周期元素相關(guān)知識(shí)回答下列問(wèn)題:
(1)按原子序數(shù)遞增的順序(稀有氣體除外),下列說(shuō)法正確的是
a.原子半徑和離子半徑均減小; b.金屬性減弱,非金屬性增強(qiáng);
c.氧化物對(duì)應(yīng)的水化物堿性減弱,酸性增強(qiáng); d.單質(zhì)的熔點(diǎn)降低.
(2)原子最外層電子數(shù)與次外層電子數(shù)相同的元素名稱為,氧化性最弱的簡(jiǎn)單陽(yáng)離子是
(3)已知:
工業(yè)制鎂時(shí),電解MgCl2而不電解MgO的原因是化合物 MgO Al2O3 MgCl2 AlCl3 類型 離子化合物 離子化合物 離子化合物 共價(jià)化合物 熔點(diǎn)/℃ 2800 2050 714 191
制鋁時(shí),電解Al2O3而不電解AlCl3的原因是
(4)晶體硅(熔點(diǎn)1410℃)是良好的半導(dǎo)體材料,由粗硅制純硅過(guò)程如下:
Si(粗)SiCl4Cl2460℃SiCl4(純)蒸餾Si(純)H21100℃
寫(xiě)出SiCl4的電子式:.在上述由SiCl4制純硅的反應(yīng)中,測(cè)得每生成1.12kg純硅需吸收a kJ熱量,寫(xiě)出該反應(yīng)的熱化學(xué)方程式:
(5)P2O5是非氧化性干燥劑,下列氣體不能用濃硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于實(shí)驗(yàn)室制O2,若不加催化劑,400℃時(shí)分解只生成兩種鹽,其中一種是無(wú)氧酸鹽,另一種鹽的陰陽(yáng)離子個(gè)數(shù)比為1:1,寫(xiě)出該反應(yīng)的化學(xué)方程式:.組卷:1860引用:29難度:0.5


