2014年4月全國100所名校單元檢測卷化學(十一)水溶液中的離子平衡(全國西部)
發布:2024/11/3 15:30:2
一、選擇題(本題包括15小題,每小題3分,共45分.每小題只有一個選項符合題意)
-
1.如表為家庭中一些常見物質的pH,有些昆蟲如蜂、螞蟻等叮咬人時,會向人體注入一種叫蟻酸(具有酸的性質)的物質,使皮膚紅腫,要消除這種癥狀,可在叮咬處涂抹上表中的最佳物質是( )
物質 食醋 米酒 食鹽水 肥皂水 pH 3 7.1 7 10 A.食醋 B.米酒 C.食鹽水 D.肥皂水 組卷:19引用:1難度:0.9 -
2.對H2O的電離平衡不產生影響的粒子是( )
A. 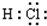
B.13M3+ C. 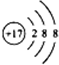
D.  組卷:10引用:3難度:0.9
組卷:10引用:3難度:0.9 -
3.如圖表示的是某離子X的水解過程示意圖,則離子X可能是( )
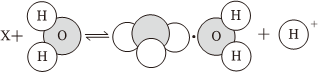
A. CO2-3B. HCO-3C.Na+ D. NH+4組卷:284引用:19難度:0.9 -
4.在氨水中,NH3?H2O電離達到平衡的標志是( )
A.溶液顯電中性 B.溶液中檢測不出NH3?H2O分子的存在 C.c(OH-)恒定不變 D.c(NH4+)=c(OH-) 組卷:72引用:3難度:0.9 -
5.已知HA為酸性略強于醋酸的一元弱酸,則0.1mol?L-1的NaA溶液的pH最有可能是( )
A.5.6 B.7.0 C.9.0 D.13.0 組卷:30引用:1難度:0.9 -
6.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.由水電離產生的c(H+)=10-12 mol?L-1的溶液中:K+、Na+、ClO-、I- B.c(H+)= 的溶液中:K+、Fe3+、Cl-、KwCO2-3C.常溫下, =1×10-12的溶液中:K+、c(H+)c(OH-)、AlO-2、Na+CO2-3D.pH=13的溶液中: 、Cl-、AlO-2、HCO-3SO2-4組卷:15引用:3難度:0.7 -
7.常溫時,在X的溶液中先滴入幾滴酚酞溶液后變紅,再加入等體積的Y的溶液,混合溶液一定顯紅色的是(溶液物質的量濃度均為0.01mol/L)
X Y A 氫氧化鋇 明礬 B 醋酸鈉 醋酸 C 碳酸氫鈉 石灰水 D 氫氧化鈉 硫酸 A.A B.B C.C D.D 組卷:12引用:5難度:0.7
二、非選擇題(本題包括6小題,共55分)
-
20.實驗室常以天青石(主要成分為硫酸鍶,含不溶性雜質)為原料制備碳酸鍶(SrCO3).試回答下列問題:
(1)將天青石礦和炭混合后,高溫焙燒過程中的產物為SrS(可溶于水)和CO,試寫出該反應過程的化學方程式:.
(2)碳酸鍶的另一種制備方法是用天青石和Na2CO3溶液混合浸泡制得,反應的離子方程式為SrSO4+?SrCO3+CO2-3.SO2-4
①若將Na2CO3換成(NH4)2CO3,則SrCO3的產率將降低,其原因是.
②25℃時,對于濃度均為0.2mol?L-1的NaHCO3和Na2CO3溶液,下列判斷中正確的是.
A.均存在電離平衡和水解平衡
B.存在的粒子種類相同
C.溶液中陰離子的物質的量濃度之和:NaHCO3溶液>Na2CO3溶液
D.溶液中由水電離出的H+個數:Na2CO3溶液>NaHCO3溶液
(3)已知Ksp(SrSO4)=3×10-7,Ksp(SrCO3)=3×10-10,向1L SrCO3的飽和溶液中加入Na2SO4固體,當開始產生沉淀時,所需Na2SO4的質量為.(假設溶液體積保持不變)組卷:23引用:2難度:0.3 -
21.A、B、C、D、E五種溶液分別是NaOH溶液、NH3?H2O溶液、CH3COOH溶液、HCl溶液、NH4HSO4溶液中的一種.常溫下進行下列實驗:
①將1L pH=3的A溶液分別與x L 0.001mol?L-1B溶液、y L 0.001mol?L-1D溶液充分反應至中性,x、y的大小關系為y<x;
②濃度均為0.1mol?L-1的A和E溶液中:pH(A)<pH(E);
③濃度均為0.1mol?L-1的C與D溶液等體積混合,溶液呈酸性.
回答下列問題:
(1)D是,判斷理由是
(2)用水稀釋0.1mol?L-1的B時,溶液中隨著水量的增加而減小的是(填序號,下同).
①②c(B)c(OH-)③c(H+)和c(OH-)的乘積 ④n(OH-)c(OH-)c(H+)
(3)c(OH-)和體積均相等的兩份溶液A和E,分別與鋅粉反應,若最后僅有一份溶液中存在鋅粉,且放出氫氣的質量相同,則下列說法正確的是.
①反應所需要的時間:E>A
②開始反應時的速率:A>E
③參加反應的鋅粉的物質的量:A=E
④反應過程的平均速率:E>A
⑤A溶液中有鋅粉剩余
⑥E溶液中有鋅粉剩余.組卷:26引用:1難度:0.5


