2021-2022學年四川師大附中(安寧校區(qū))高二(上)期中化學試卷
發(fā)布:2024/10/26 3:30:2
一、單項選擇題(本題有30個小題,每小題2分,共50分.每小題只有一個正確的選項,請選出符合題意的正確選項,并在答題卡上將該選項對應的字母涂黑.不選、多選、錯選均不得分.)
-
1.航天技術離不開化學,下列有關說法正確的是( )
A.北斗衛(wèi)星上所用的太陽能電池組,可將化學能轉化為電能 B.長征火箭上所用的碳纖維材料,屬于有機高分子材料 C.嫦娥五號返回艙所用的高溫結構陶瓷,屬于傳統(tǒng)硅酸鹽材料 D.“天和”核心艙變軌動力依靠電推發(fā)動機:相對于化學燃料更加經濟與環(huán)保 組卷:11引用:2難度:0.9 -
2.用NA表示阿伏加德羅常數(shù)的值,下列敘述不正確的是( )
A.含有NA個氖原子的氖氣在標準狀況下的體積約為22.4L,其電子數(shù)為10NA B.在常溫常壓下,11.2LN2含有的分子數(shù)為0.5NA C.25℃,1.01×105Pa,64gSO2中含有的原子數(shù)為3NA D.1L0.5mol/L的AlCl3溶液中所含Cl-數(shù)為1.5NA 組卷:0引用:2難度:0.8 -
3.已知還原性:SO2>I->Fe2+,下列離子反應不能發(fā)生的是( )
A.SO2+2Fe3++2H2O═ +2Fe2++4H+SO2-4B.I2+2Fe2+═2I-+2Fe3+ C.SO2+I2+2H2O═2I-+4H++ SO2-4D.少量Cl2通入FeI2溶液中:Cl2+2I-═2Cl-+I2 組卷:174引用:23難度:0.7 -
4.為達到實驗目的,下列實驗設計錯誤的是( )
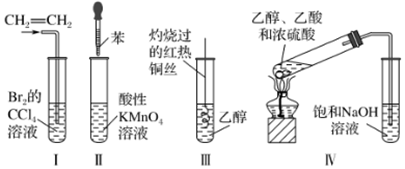
A.實驗Ⅰ探究乙烯能與Br2反應 B.實驗Ⅱ探究苯分子中是否含有碳碳雙鍵 C.實驗Ⅲ探究乙醇的還原性 D.實驗Ⅳ制取少量乙酸乙酯 組卷:7引用:1難度:0.6 -
5.在研究物質變化時,人們可以從不同的角度、不同的層面來認識物質變化,以下敘述中錯誤的是( )
A.化學反應中物質變化的實質是舊化學鍵斷裂和新化學鍵生成 B.物質燃燒可看成“儲存”在物質內部的能量(化學能)轉化為熱能釋放出來 C.在化學反應中,破壞舊化學鍵吸收的能量大于形成新化學鍵釋放的能量時,該反應是吸熱反應 D.增大反應物濃度、使用催化劑、升高溫度都可增大活化分子百分數(shù),增大單位時間內有效碰撞次數(shù),從而加快反應 組卷:10引用:2難度:0.8 -
6.測定中和反應反應熱的實驗中,下列做法會導致反應熱偏小的是( )
A.用KOH溶液代替NaOH溶液 B.用NaOH固體代替NaOH溶液 C.反應物鹽酸過量 D.使用銅制攪拌棒攪拌 組卷:9引用:3難度:0.9 -
7.反應A+B→C(△H<0)分兩步進行 ①A+B→X (△H>0)②X→C(△H<0)下列示意圖中,能正確表示總反應過程中能量變化的是( )
A. 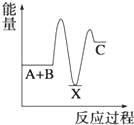
B. 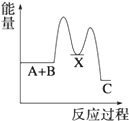
C. 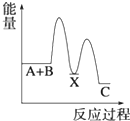
D. 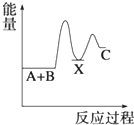 組卷:3363引用:157難度:0.9
組卷:3363引用:157難度:0.9 -
8.下列說法不正確的是( )
A.明礬能水解生成Al(OH)3膠體,可用作凈水劑 B.用熱的純堿溶液去油污效果更好 C.制備無水的CuCl2、FeCl3均不能采用將溶液在空氣中直接蒸干的方法 D.草木灰和銨態(tài)氮肥混合使用,肥效增強 組卷:2引用:2難度:0.8 -
9.已知:4NH3+5O2═4NO+6H2O(g),若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L?min)]表示,則正確的關系式是( )
A. v(NH3)=v(O2)45B. v(O2)=v(H2O)56C. v(NH3)=v(H2O)23D. v(O2)=v(NO)45組卷:12引用:2難度:0.5
二、非選擇題(本題有4個小題,每空2分,共50分)
-
28.“綠水青山就是金山銀山”,因此研究NOx、SO2等大氣污染物的妥善處理具有重要意義。
(1)SO2的排放主要來自于煤的燃燒,工業(yè)上常用氨水吸收法處理尾氣中的SO2.已知吸收過程中相關反應的熱化學方程式如下:
①SO2(g)+NH3?H2O(aq)═NH4HSO3(aq)△H1=akJ?mol-1;
②NH3?H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(ag)+H2O(l)△H2=bkJ?mol-1;
③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=ckJ?mol-1。
則反應2SO2(g)+4NH3?H2O(aq)+O2(g)═2(NH4)2SO4(aq)+2H2O(l)的△H=kJ?mol-1。
(2)燃煤發(fā)電廠常利用反應2CaCO3(s)+2SO2(g)+O2(g)═2CaSO4(s)+2CO2(g)△H=-681.8kJ?mol-1對煤進行 脫硫處理來減少SO2的排放。對于該反應,在T℃時,借助傳感器測得反應在不同時間點上各物質的濃度如表:
①0~10min 內,平均反應速率v(O2)0 10 20 30 40 50 O2/(mol?L-1) 1.00 0.79 0.60 0.60 0.64 0.64 CO2/(mol?L-1) 0 0.42 0.80 0.80 0.88 0.88 mol?L-1?min-1;當升高溫度,該反應的平衡常數(shù)K(填“增大”“減小”或“不變”)。
②30min后,只改變某一條件,反應重新達到平衡。根據(jù)如表中的數(shù)據(jù)判斷,改變的條件可能是(填字母)。
A.加入一定量的粉狀碳酸鈣 B.通入一定量的O2
C.適當縮小容器的體積 D.加入合適的催化劑
(3)NOx的排放主要來自于汽車尾氣,有人利用反應C(s)+2NO(g)?N2(g)+CO2(g)△H=-34.0kJ?mol-1,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得NO的轉化率隨溫度的變化如圖所示: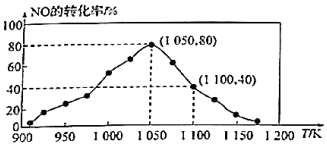
由圖可知,1050K前反應中NO的轉化率隨溫度升高而增大,其原因為;在1100K時,CO2的體積分數(shù)為。
(4)用某物質的平衡分壓代替其物質的量濃度也可以表示化學平衡常數(shù)(記作Kp)。在1050K、1.1×106Pa時,該反應的化學平衡常數(shù)Kp=[已知:氣體分壓(P分)=氣體總壓(Pa)×體積分數(shù)]。
(5)為避免汽車尾氣中的有害氣體對大氣的污染,需給汽車安裝尾氣凈化裝置。在凈化裝置中CO和NO發(fā)生反應2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8k?mol-1,生成無毒的N2和CO2.實驗測得,v正=k正?c2(NO)?c2(CO),v逆=k逆?c(N2)?c2(CO2)(k正、k逆為速率常數(shù),只與溫度有關)。
①達到平衡后,僅升高溫度,k正增大的倍數(shù)(填“>”“<”或“=”)k逆增大的倍數(shù)。
②若在1L的密閉容器中充入1mol CO 和1mol NO,在一定溫度下達到平衡時,CO的轉化率為40%,則=k正k逆。組卷:27引用:2難度:0.5 -
29.電化學在日常生產生活中有廣泛的應用,請回答問題:
(1)高鐵酸鉀(K2FeO4)不僅是一種理想的水處理劑,而且高鐵電池的研制也在進行中.如圖1所示是高鐵電池的模擬實驗裝置.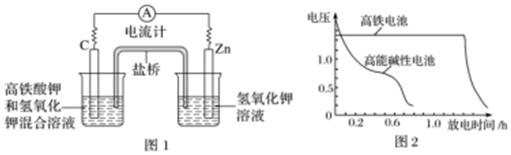
①該電池放電時正極反應式為.
②鹽橋中盛有飽和KCl溶液,此鹽橋中氯離子向(填“左”或“右”)移動;
③圖2為高鐵電池和常用的高能堿性電池的放電曲線,由此可得出高鐵電池的優(yōu)點有.
(2)SO2和NOx是主要大氣污染物,利用如圖裝置可同時吸收SO2和NO.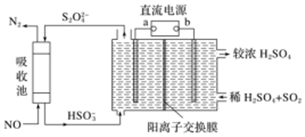
①a是直流電源的極.
②已知電解池的陰極室中溶液的pH在4~7之間,陰極的電極反應為.
③用離子方程式表示吸收NO的原理.組卷:9引用:3難度:0.6


