2021-2022學年江蘇省揚州市高郵市九年級(上)期末化學試卷
發布:2024/4/20 14:35:0
一.選擇題本題包括20小題,每小題2分,共40分。每小題只有一個選項符合題意。
-
1.人與自然和諧共生是人類生存和發展的基礎。下列做法與此不相符的是( )
A.開發清潔新能源,防治大氣污染 B.使用可降解塑料,減少白色污染 C.研制無污染農藥,減輕水體污染 D.深埋廢鉛蓄電池,防止土壤污染 組卷:62引用:1難度:0.5 -
2.鐵是目前使用最廣泛的金屬。下列過程中沒有發生化學變化的是( )
A.鐵絲織網 B.礦石煉鐵 C.煉鐵成鋼 D.濕法煉銅 組卷:8引用:1難度:0.8 -
3.下列物質由原子構成的是( )
A.水 B.金剛石 C.氮氣 D.氯化鈉晶體 組卷:7引用:1難度:0.6 -
4.下列物質含有氫分子的是( )
A.Ca(OH)2 B.H2CO3 C.H2O2 D.H2 組卷:1188引用:46難度:0.5 -
5.如圖為“節水標志”的是( )
A. 
B. 
C. 
D.  組卷:15引用:2難度:0.8
組卷:15引用:2難度:0.8 -
6.含有“氚”的核廢水直接排放會對人類生存環境造成一定的影響。氚原子的原子核內含有1個質子和2個中子,其核外電子數是( )
A.1 B.2 C.3 D.6 組卷:554引用:6難度:0.6 -
7.下列洗滌方法中,利用乳化原理的( )
A.用汽油清洗油漬 B.用稀鹽酸除鐵銹 C.用洗潔精清洗油污 D.用食醋除水垢 組卷:40引用:68難度:0.9 -
8.安全無小事,關乎你我他。下列做法正確的是( )
A.油鍋著火用水澆滅 B.熄滅酒精燈用嘴吹滅 C.電路著火先切斷電源 D.燃氣泄漏先電話報警 組卷:22引用:1難度:0.7
二.非選擇題
-
24.硬水加熱時易產生水垢,很多工業用水需要對硬水進行軟化處理。小組同學利用1.5%的肥皂水比較水的硬度。
【查閱資料】硬水含較多可溶性鈣、鎂化合物:軟水不含或含較少可溶性鈣、鎂化合物。
Ⅰ.探究水的硬度、肥皂水的用量與產生泡沫量的關系
【進行實驗】向蒸餾水中加入CaCl2和MgCl2的混合溶液,配制兩種不同硬度的硬水。
用蒸餾水和兩種硬水完成三組實驗,記錄如下:
【解釋與結論】組別 第1組 第2組 第3組 實驗
操作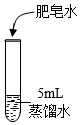
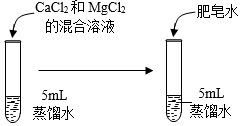
實驗序號 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ 混合溶液用量/滴 0 0 0 1 x 1 2 2 2 肥皂水用量/滴 5 10 20 5 10 20 5 10 20 產生泡沫量 少 多 很多 無 少 多 無 無 少
(1)CaCl2在水溶液中完全以離子形式存在,寫出鈣離子、氯離子的化學符號、。
(2)對比②和⑧可知,肥皂水能區分軟水和硬水,依據的現象是。
(3)設計第2組實驗時,為控制水的硬度相同,⑤中x應為。
(4)第2組實驗的目的是。
(5)由上述三組實驗得到的結論是。
Ⅱ.比較不同水樣的硬度
【進行實驗】用四種水樣完成實驗,記錄觀察到泡沫產生時所需肥皂水的用量。
【解釋與結論】實驗操作 水樣 肥皂水用量/滴 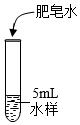
市售純凈水 2 煮沸后的自來水 6 自來水 9 湖水 14
(6)硬度最大的水樣是。
(7)由上述實驗可知,能將自來水硬度降低的方法有。
(8)繼續實驗,發現山泉水的硬度大于自來水的硬度,其實驗方案為(提示:實驗方案需要寫全操作、現象、結論)。組卷:54引用:2難度:0.5 -
25.同學們對三星堆遺址的Ⅱ號青銅神樹展開研究性學習。
【查閱資料】科研人員對Ⅱ號青銅神樹座進行過如下測定。
①用光譜儀測定金屬材料成分,得到如下數據:含Cu 75.1%,含Sn 5.6%,含Pb 16.2%。
②用X衍射儀測定樹座外側銅銹成分為堿式氯化銅【Cu2(OH)3Cl】。
【分析研究】
(1)鑄造銅樹時,在銅中加入錫和鉛會使材料的熔點(選填“降低”、“升高”)。
(2)青銅器中的銅在氯離子等作用下,生成活性很強的氯化亞銅(CuCl)。CuCl易與O2、H2O反應生成氯化氫和堿式氯化銅【Cu2(OH)3Cl】,該反應的化學方程式為。
同學們發現生活中銅制品長期露置在潮濕空氣中也會銹蝕生成“銅綠”【Cu2(OH)2CO3】。
【實驗探究】
為探究生活中某銹蝕銅樣品中單質銅的質量分數,并回收銅。
查閱資料:①Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O
②Cu2O+H2SO4═CuSO4+Cu+H2O
實驗設計:取銅樣品(假設除銅和銅綠外,不含其它物質),設計甲、乙兩方案。
方案甲: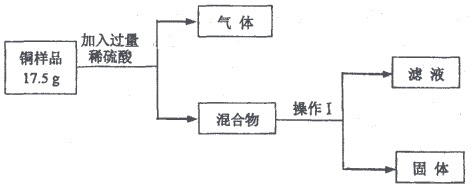
(3)所得固體經操作Ⅰ、洗滌、干燥,稱得質量為6.4g,其中操作Ⅰ的名稱為,銅樣品中單質銅的質量分數為(結果保留到0.1%)。
(4)濾液中的陽離子有(填離子符號)。
方案乙:
(5)步驟Ⅰ中銅綠受熱分解生成黑色固體A、CO2和H2O,過程中還有另一個化合反應也生成黑色固體A,黑色固體A的化學式為。
(6)步驟所得銅中往往含有少量的Cu2O。檢驗銅中含有Cu2O的實驗方法為:取樣于試管中,向其中加入適量的稀硫酸觀察到(填實驗現象),證明銅中含有Cu2O。
(7)步驟Ⅱ還原16.0g黑色固體A,得到Cu和Cu2O的混合物共ag。則a的值范圍為12.8g<a<(寫出計算過程)
【實驗反思】
(8)①方案甲中,若所得固體在空氣中進行加熱干燥,則測得銅樣品中單質銅的質量分數將(填“偏大”“偏小”或“無影響”);還可能有哪些操作因素也會導致銅樣品中單質銅的質量分數產生偏差(任寫一點)。
②方案甲中,若需對所得濾液中的銅進行回收,則可以加入一種稍過量的金屬,寫出該反應的化學方程式(任寫一個)。
(9)小組同學針對如何將方案乙中氧化銅全部轉化為銅單質展開討論。查閱資料得知,反應條件是影響轉化的重要因素,你認為:實驗中可采取的措施有(任寫一點)。組卷:102引用:2難度:0.3


