2020-2021學年河南省開封市五縣高二(下)期末化學試卷
發布:2024/11/23 13:30:2
一、選擇題(總計42分,每小題只有一個正確選項,每小題3分)
-
1.宋應星所著《天工開物》共三卷十八篇,書中收錄有關機械、磚瓦、陶瓷,火藥硫磺等的生產技術。被外國學者譽稱為17世紀中國工藝百科全書。下列有關說法不正確的是( )
A.凡白土曰堊土,為陶家精美啟用中陶是一種傳統硅酸鹽材料 B.古人煮沸海水制取淡水,現代可通過向海水加入明礬實現海水淡化 C.每紅銅六斤,入倭鉛四斤,先后入罐熔化,冷定取出,即成黃銅中的黃銅是合金 D.凡火藥,硫為純陽,硝為純陰中硫指的是硫黃,硝指的是硝酸鉀 組卷:40引用:2難度:0.6 -
2.下列有關金屬及其化合物的對應關系中正確的是( )
A.Fe3O4為紅棕色晶體,有磁性,故Fe3O4可以做用作磁鐵 B.Na在O2中燃燒生成白色固體,白色固體是Na2O C.Al2O3具有兩性,故能用于冶煉金屬鋁 D.除去FeCl3溶液中的FeCl2雜質可以向溶液中通入氯氣 組卷:40引用:1難度:0.5 -
3.下列物質在生活中的應用與氧化還原反應無關的是( )
A.碳酸鈉俗稱純堿,熱的純堿溶液可以去油污 B.還原Fe粉用作食品脫氧劑 C.FeSO4補血劑與維生素C配合使用效果更佳 D.NaOH溶液滴入FeSO4溶液中產生白色沉淀,隨后變為灰綠色,最后變為紅褐色 組卷:54引用:1難度:0.8 -
4.某澄清水溶液,只可能含有以下離子中的若干種,且各離子物質的量濃度相等(忽略水的電離):Na+、K+、Cl-、Ba2+、CO32-、SO42-,取少量該溶液于試管,加BaCl2溶液后出現白色沉淀。一定存在的離子有( )
A.Ba2+、Cl- B.SO42-、Na+ C.Na+、K+ D.CO32-、SO42- 組卷:84引用:7難度:0.7 -
5.下列指定反應的離子方程式正確的是( )
A.用醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O B.KClO堿性溶液與Fe(OH)3反應:3ClO-+2Fe( OH)3═2FeO42-+3Cl-+4H++H2O C.NH4HCO3溶于過量的NaOH溶液中:HCO3-+OH-═CO32-+H2O D.電解飽和食鹽水獲取燒堿和氯氣:2Cl-+2H2O H2↑+Cl2↑+2OH-電解組卷:27引用:1難度:0.6 -
6.下列有關物質的分類中正確的是( )
選項 A B C D 名稱 
碳納米管
聚乙烯塑料
“84”消毒液
膽礬分類 高分子化合物 混合物 純凈物 弱電解質 A.A B.B C.C D.D 組卷:50引用:1難度:0.6
二、非選擇題(共58分)
-
17.乳酸亞鐵晶體[CH3CH(OH)COO]2Fe?3H2O(M=288)是一種很好的食品鐵強化劑,易溶于水,吸收效果比無機鐵好,可由乳酸CH3CH(OH) COOH與FeCO3反應制得:
Ⅰ.制備碳酸亞鐵
(1)儀器C的名稱是。
(2)利用如圖所示裝置進行實驗。首先關閉活塞2,打開活塞1、3,目的是;關閉活塞1,反應一段時間后,關閉活塞,打開活塞,觀察到B中溶液進入到C中,C中產生沉淀和氣體,寫出制備FeCO3的離子方程式。
(3)裝置D的作用是。
Ⅱ.乳酸亞鐵晶體的制備及純度測定
將制得的FeCO3加入到乳酸溶液中,加入少量鐵粉,在75℃下攪拌使之充分反應。然后再加入適量乳酸,從所得溶液中獲得乳酸亞鐵晶體。
(4)加入少量鐵粉的作用是。
(5)若用KMnO4滴定法測定樣品中Fe2+的量進而計算純度時,發現結果總是大于100%,其主要原因是。
(6)經查閱文獻后,改用Ce(SO4)2標準溶液進行滴定。反應中Ce4+離子的還原產物為Ce3+.測定時,先稱取5.760 g樣品,溶解后進行必要處理,用容量瓶配制成250 mL溶液,每次取25.00 mL,用0.1000 mol?L-1 Ce(SO4)2標準溶液滴定至終點,記錄數據如表所示。
則產品中乳酸亞鐵晶體的純度為滴定次數 0.100 mol?L-1Ce(SO4)2標準溶液體積/mL 滴定前讀數 滴定后讀數 1 0.20 19.65 2 0.22 21.42 3 1.15 20.70 %(保留小數點后兩位)。組卷:35引用:2難度:0.5 -
18.甲醇是重要的化工原料,又可作為燃料。以CO2和H2為原料生產甲醇時,同時發生下列兩個反應,反應的熱化學方程式如下:
Ⅰ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58.0kJ?mol-1
Ⅱ.CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.0kJ?mol-1
(1)上述兩個反應中,在熱力學上趨勢較大的是(填反應代號)。
(2)如圖1中表示反應II平衡常數K隨溫度變化關系的曲線為(填曲線標記字母),其判斷依據是。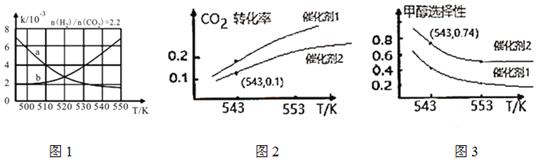
(3)CO和H2反應也可生成氣態甲醇。相關的化學鍵鍵能數據如下:
①則x=化學鍵 H-H C-O C≡O H-O C-H E/(kJ?mol-1) 436 343 1076 465 x 。
②CO和H2生成甲醇的反應,體系總壓強為P MPa恒定,在溫度T時,起始=n(CO)n(H2),若到達平衡時,CO的轉化率為50%,則平衡常數Kp=12(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(4)某實驗室控制CO2和H2初始投料比為1:2.2。在相同壓強下,發生I、II兩個反應,經過相同反應時間測得如下實驗數據如圖2、圖3所示:
①有利于提高CO2轉化為CH3OH平衡轉化率的措施有。
A.使用催化劑1
B.增大CO2和H2的初始投料比
C.使用催化劑2
D.投料比不變,增加反應物的濃度
②在催化劑2的作用下,543 K時,CO的選擇性(CO2轉化為CO的體積百分比)為,H2的轉化率為(保留兩位有效數字)。組卷:6引用:1難度:0.4


