2020年浙江省臺州市仙居中學高考化學模擬試卷(3月份)
發布:2024/4/20 14:35:0
一、選擇題(本大題共25小題,每小題2分,共50分。每個小題列出的四個備選項中只有一個是符合題目要求的,不選、多選、錯選均不得分)
-
1.下列實驗操作不當的是( )
A.用稀硫酸和鋅粒制取H2時,加幾滴CuSO4溶液以加快反應速率 B.用標準HCl溶液滴定 NaHCO3溶液來測定其濃度,選擇酚酞為指示劑 C.用鉑絲蘸取某堿金屬的鹽溶液灼燒,火焰呈黃色,證明其中含有Na+ D.常壓蒸餾時,加入液體的體積不超過圓底燒瓶容積的三分之二 組卷:1260引用:12難度:0.7 -
2.已知某鹽在不同溫度下的溶解度如表。若把質量分數為 22%的該鹽溶液由50℃逐漸冷卻,則開始析出晶體的溫度范圍是( )
溫度(℃) 0 10 20 30 40 溶解度(g) 11.5 15.1 19.4 24.4 37.6 A.0~10℃ B.10~20℃ C.20~30℃ D.30~40℃ 組卷:7引用:1難度:0.9 -
3.下列實驗操作或實驗事故處理正確的是( )
A.實驗室制溴苯時,將苯與溴水混合后加到有鐵絲的反應容器中 B.實驗室制硝基苯時,將硝酸與苯混合后再滴加濃硫酸 C.在濃鹽酸作用下,苯酚和甲醛反應可合成線型酚醛樹脂 D.實驗時手指不小心沾上苯酚,立即用70℃以上的熱水清洗 組卷:5引用:1難度:0.8 -
4.欲從溶有苯酚的乙醇中回收苯酚,有下列操作①蒸餾 ②過濾 ③靜置分液 ④加入足量的金屬鈉 ⑤通入過量的CO2氣體 ⑥加入足量的NaOH溶液 ⑦加入足量的FeCl3溶液 ⑧加入濃H2SO4與NaBr晶體共熱.下列步驟中最合理的是( )
A.④⑤③ B.⑥①⑤③ C.⑥①⑤② D.⑧②⑤③ 組卷:91引用:5難度:0.9 -
5.下列關于實驗原理或操作的敘述中,不正確的是( )
A.從碘水中提取單質碘時,不能用無水乙醇代替CCl4 B.可用新制的Cu(OH)2懸濁液檢驗牙膏中存在的甘油 C.紙層析實驗中,須將濾紙上的試樣點浸入展開劑中 D.實驗室中提純混有少量乙酸的乙醇,可采用先加生石灰,過濾后再蒸餾的方法 組卷:350引用:5難度:0.7 -
6.化工生產與人類進步緊密相聯。下列有關說法不正確的是( )
A.空氣吹出法提取海水中溴通常使用SO2作還原劑 B.侯氏制堿法工藝流程中利用了物質溶解度的差異 C.合成氨采用高溫、高壓和催化劑主要是提高氫氣平衡轉化率 D.工業用乙烯直接氧化法制環氧乙烷體現綠色化學和原子經濟 組卷:109引用:5難度:0.7 -
7.CuO有氧化性,能被NH3還原,為驗證此結論,設計如圖實驗。有關該實驗的說法正確的是( )

A.反應時生成一種無污染的氣體NO B.NH3與CuO反應后生成的紅色物質可能是Cu C.裝濃氨水的裝置名稱是分液漏斗,只能用作分液操作 D.燒杯中硫酸的作用是防倒吸 組卷:82引用:2難度:0.6 -
8.除去下列括號內雜質的試劑或方法不正確的是( )
A.CO2(SO2):酸性KMnO4溶液、濃硫酸,洗氣 B.KNO3晶體(NaCl):蒸餾水,結晶 C.HNO3溶液(H2SO4):適量BaCl2溶液,過濾 D.苯(甲苯):先用酸性高錳酸鉀溶液,后用NaOH溶液處理 組卷:1引用:1難度:0.5 -
9.中科院長春應化所張新波團隊提出了一種獨特的鋰一氮(Li-N2)電池,該電池在放電過程中消耗氮氣,充電過程中釋放氮氣,實現了氮氣的循環,并對外提供電能。該電池總反應為2Li3N
N2↑+6Li。現以該電池為電源進行如圖所示實驗,下列說法正確的是( )充電放電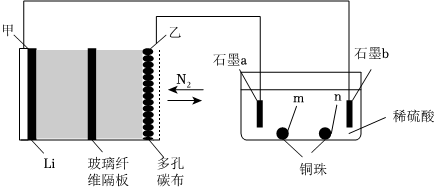
A.乙電極上的反應為2Li3N-6e-═N2↑+6Li+ B.充電過程中Li+由甲電極遷移向乙電極,并在多孔碳布表面生成Li3N C.電極“石墨a”和m、n處均可能有銅析出 D.鋰-氮電池為綠色固氮提供了一種可能 組卷:35引用:3難度:0.5 -
10.下列實驗現象與實驗操作不相匹配的是( )
實驗操作 實驗現象 A 向盛有高錳酸鉀酸性溶液的試管中通入足量的乙烯后靜置 溶液的紫色逐漸褪去,靜置后溶液分層 B 將鎂條點燃后迅速伸入集滿CO2的集氣瓶 集氣瓶中產生濃煙并有黑色顆粒產生 C 向盛有飽和硫代硫酸鈉溶液的試管中滴加稀鹽酸 有刺激性氣味氣體產生,溶液變渾濁 D 檢驗綠茶中是否含有酚類物質 向茶水中滴加FeCl3溶液 A.A B.B C.C D.D 組卷:10引用:1難度:0.6
二、非選擇題(本大題共7小題,共50分)
-
31.催化氧化反應:2SO2(g)+O2(g)?2SO3(g)ΔH<0
(1)在體積可變的密閉容器中,維持壓強為101 kPa和初始n(SO2)=2mol,充入一定量的O2,SO2的平衡轉化率α(SO2)隨O2物質的量n(O2)的變化關系如圖所示: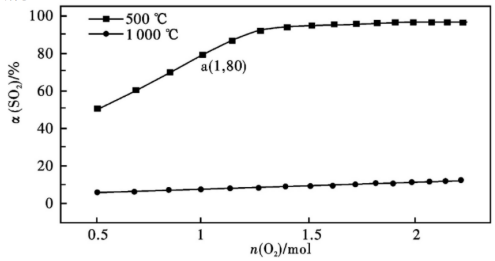
①在1000C時,SO2平衡轉化率隨著O2物質的量的增大緩慢升高,解釋其原因。
②a點時SO3的平衡分壓p(SO3)=Pa(保留兩位有效數字,某組分的平衡分壓=總壓×某組分的物質的量分數)。
(2)保持溫度不變,向固定體積的密閉容器中充入一定量的SO2、O2。請畫出平衡體系中SO3的體積分數q(SO3)隨初始SO2、O2的物質的量之比的變化趨勢圖n(SO2)n(O2)。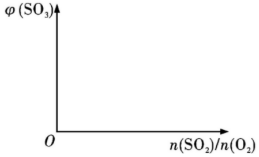
(3)已知活性氧可以把SO2快速氧化為SO 3,根據計算機模擬結果,在炭黑表面上O2轉化為活性氧的反應歷程與能量變化關系如圖所示,下列說法不正確的是(填字母代號)。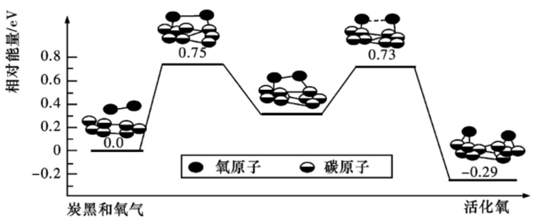
A.O2轉化為活性氧是氧氧鍵的斷裂與碳氧鍵的生成過程
B.該過程的最大能壘(活化能)E正=0.73ev
C.每活化一個O2分子最終吸收0.29ev能量
D.依題炭黑可以作為SO2轉化為SO3的催化劑E.其他條件相同時,炭黑顆粒越小,反應速率越快組卷:9引用:2難度:0.5 -
32.硫酸工廠尾氣中的SO2可被NaOH溶液吸收,用惰性電極將所得的Na2SO3液進行電解,可循環再生NaOH的同時得到H2SO4,寫出陽極的電極反應式:
。組卷:3引用:1難度:0.7


