2023-2024學(xué)年吉林省長春外國語學(xué)校高二(上)期中化學(xué)試卷
發(fā)布:2024/10/19 18:0:1
一、選擇題:本題共13小題,每小題4分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
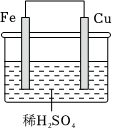 1.Fe-Cu原電池的示意圖如圖,電池工作時,下列說法正確的是( )
1.Fe-Cu原電池的示意圖如圖,電池工作時,下列說法正確的是( )A.Fe電極為正極 B.Cu電極上發(fā)生還原反應(yīng) C.H+移向Fe電極 D.外電路中電子的流動方向:Cu→導(dǎo)線→Fe 組卷:36引用:3難度:0.8 -
2.下列熱化學(xué)方程式正確的是( )
A.31g白磷比31g紅磷能量多bkJ,P4(s)=4P(s)ΔH=-4bkJ?mol-1 B.2molSO2、1molO2混合反應(yīng)后,放出熱量akJ,則2SO2(g)+O2(g)?2SO3(g)ΔH=-akJ?mol-1 C.H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ?mol-1,則H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6kJ?mol-1 D.H2的燃燒熱為akJ?mol-1,則H2(g)+ O2(g)=H2O(g)ΔH=-akJ?mol-112組卷:13引用:2難度:0.7 -
3.化學(xué)常用圖象直觀地描述化學(xué)反應(yīng)的進(jìn)程或結(jié)果。下列圖象描述不正確的是( )
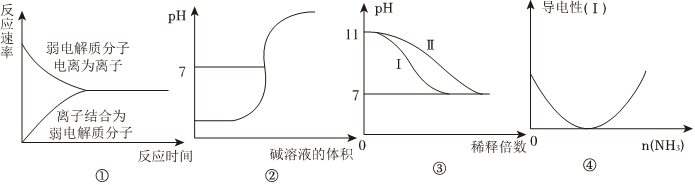
A.圖①表示弱電解質(zhì)在水中建立電離平衡的過程 B.圖②表示強堿滴定強酸的滴定曲線 C.圖③表示25℃時分別稀釋pH=11的NaOH溶液和氨水時溶液pH的變化,曲線Ⅱ表示氨水 D.圖④可表示CH3COOH溶液中通入NH3至過量的過程中溶液導(dǎo)電性的變化 組卷:63引用:5難度:0.7 -
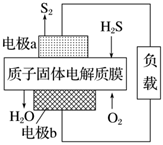 4.科學(xué)家設(shè)計出質(zhì)子膜H2S燃料電池,實現(xiàn)了利用H2S廢氣資源回收能量并得到單質(zhì)硫。質(zhì)子膜H2S燃料電池的結(jié)構(gòu)示意圖如圖所示。下列說法錯誤的是( )
4.科學(xué)家設(shè)計出質(zhì)子膜H2S燃料電池,實現(xiàn)了利用H2S廢氣資源回收能量并得到單質(zhì)硫。質(zhì)子膜H2S燃料電池的結(jié)構(gòu)示意圖如圖所示。下列說法錯誤的是( )A.電極b為電池的正極 B.電極b上發(fā)生的電極反應(yīng):O2+4H++4e-=2H2O C.標(biāo)準(zhǔn)狀況下,電路中每通過4mol電子,在負(fù)極消耗44.8LH2S D.每17gH2S參與反應(yīng),有2molH+經(jīng)質(zhì)子膜進(jìn)入正極區(qū) 組卷:110引用:1難度:0.6 -
5.空間探測器發(fā)射時常用肼(N2H4)作燃料,以二氧化氮作氧化劑,它們相互反應(yīng)生成氮氣和水蒸氣。
已知:①N2(g)+2O2(g)=2NO2(g)ΔH=+67.7kJ/mol;
②N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-534kJ/mol。
則N2H4(g)和NO2(g)反應(yīng)的熱化學(xué)方程式為( )A.2N2H4+2NO2=3N2+4H2OΔH=-1135.7kJ/mol B.N2H4(g)+NO2(g)= N2(g)+2H2O(g)ΔH=-567.85kJ/mol32C.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)ΔH=+1135.7kJ/mol D.N2H4(l)+NO2(g)= N2(g)+2H2O(g)ΔH=-567.85kJ/mol32組卷:19引用:2難度:0.7
二、填空題:本題共3小題,每小題16分。
-
15.氯化亞銅(CuCl)是常用的催化劑。以低品位銅礦(主要成分為CuS、Cu2S和鐵的氧化物等)為原料制備CuCl步驟如下:
(1)“氧化浸取”。銅元素全部轉(zhuǎn)化為Cu2+,鐵元素全部轉(zhuǎn)化為Fe3+。
①Cu2S、MnO2和硫酸反應(yīng)生成CuSO4、MnSO4和S,其化學(xué)方程式為。
②為提高銅元素的浸出率,工藝上可采取的措施有(填字母)。
A.將銅礦粉碎并攪拌
B.增加銅礦的投料量
C.適當(dāng)縮短反應(yīng)時間
D.適當(dāng)提高硫酸濃度
(2)“除鐵錳”。依次用氨水沉鐵、用氨水-NH4HCO3混合溶液沉錳。
①用氨水調(diào)節(jié)溶液的pH為3時,c(Fe3+)為mol?L-1。(常溫下,Ksp[Fe(OH)3]=3×10-39)
②向除鐵后的溶液中滴加氨水-NH4HCO3混合溶液,反應(yīng)生成MnCO3的離子方程式為。
(3)“還原”。CuSO4溶液、NaCl溶液和Na2SO3溶液反應(yīng)生成CuCl沉淀。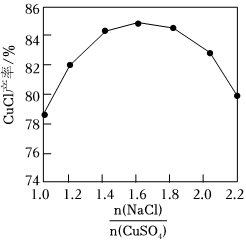
已知:CuCl易被O2氧化,易與Cl-形成可溶的[CuCl2]-。
①反應(yīng)生成CuCl的離子方程式為。
②如圖所示,n(CuSO4)和其他條件相同時,CuCl產(chǎn)率隨增大先升高后降低的原因是n(NaCl)n(CuSO4)。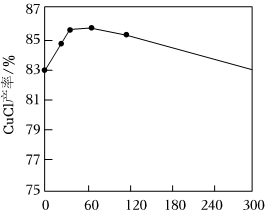
③如圖所示,其他條件相同時,CuCl產(chǎn)率隨反應(yīng)時間延長而降低的原因是。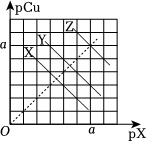
(4)已知:pCu=-lgc(Cu+),pX=-lgc(X-),式中X-表示鹵素陰離子。298K時,Ksp(CuCl)≈1.0×10-7,Ksp(CuBr)≈1.0×10-9,Ksp(CuI)≈1.0×10-12。298K時,CuCl、CuBr、CuI的飽和溶液中pCu和pX的關(guān)系如圖所示。圖中X代表的曲線,且a=組卷:3引用:1難度:0.5 -
16.我國力爭2030年前實現(xiàn)碳達(dá)峰,2060年前實現(xiàn)碳中和。CO2的綜合利用是實現(xiàn)碳中和的措施之一。
Ⅰ.CO2和CH4在催化劑表面可以合成CH3COOH,該反應(yīng)的歷程和相對能量的變化情況如圖所示(*指微粒吸附在催化劑表面,H*指H吸附在催化劑載體上的氧原子上,TS表示過渡態(tài)):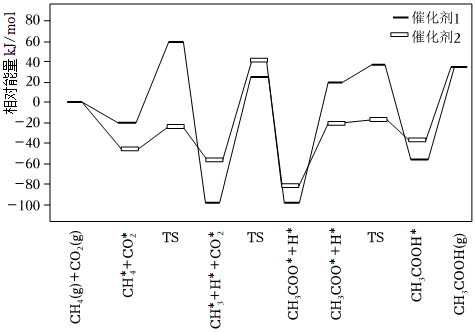
(1)決定該過程的總反應(yīng)速率的基元反應(yīng)方程式為。
(2)下列說法正確的有。
a.增大催化劑表面積可提高CO2在催化劑表面的吸附速率
b.CH3COOH*比CH3COOH(g)能量高
c.使用高活性催化劑可降低反應(yīng)焓變,加快反應(yīng)速率
d.催化效果更好的是催化劑2
Ⅱ.CO2和H2在一定條件下也可以合成甲醇,該過程存在副反應(yīng)ii。
反應(yīng)i:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH1=-49.3kJ?mol-1
反應(yīng)ii:CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2
(3)有關(guān)物質(zhì)能量變化如圖所示,穩(wěn)定單質(zhì)的焓(H)為0,則ΔH2=kJ?mol-1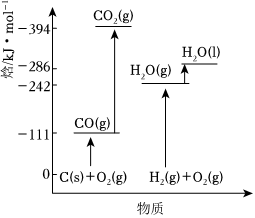
(4)CO(g)+2H2(g)?CH3OH(g)ΔH3該反應(yīng)的自發(fā)條件是(填“高溫自發(fā)”“低溫自發(fā)”或“任何溫度下都自發(fā)”)
(5)恒溫恒容條件下,僅發(fā)生反應(yīng)ii,反應(yīng)達(dá)到平衡的標(biāo)志是。
a.CO的分壓不再發(fā)生變化
b.氣體平均相對分子質(zhì)量不再發(fā)生變化
c.比值不再發(fā)生變化c(CO2)?c(H2)c(CO)?c(H2O)
d.氣體密度不再發(fā)生變化
(6)在5.0MPa,將n(CO2):n(H2)=5:16的混合氣體在催化劑作用下進(jìn)行反應(yīng)。體系中氣體平衡組成比例(CO和CH3OH在含碳產(chǎn)物中物質(zhì)的量百分?jǐn)?shù))及CO2的轉(zhuǎn)化率隨溫度的變化如圖所示。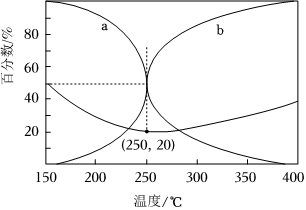
①表示平衡時CH3OH在含碳產(chǎn)物中物質(zhì)的量百分?jǐn)?shù)的曲線是(填“a”或“b”)。
②CO2平衡轉(zhuǎn)化率隨溫度的升高先減小后增大,增大的原因可能是。
③250℃時反應(yīng)i:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的Kp=(MPa)-2(用最簡分?jǐn)?shù)表示)。組卷:25引用:1難度:0.5


