2021-2022學(xué)年重慶市南開(kāi)中學(xué)高二(下)期中化學(xué)試卷
發(fā)布:2024/12/5 18:30:2
一、(單選題共42分)本卷共14題,每小題3分,共計(jì)42分,每小題只有一個(gè)正確選項(xiàng).
-
1.化學(xué)與生活、生產(chǎn)、環(huán)境密切相關(guān).下列說(shuō)法不正確的( )
A.瑪瑙、水晶、鉆石,紅寶石等裝飾品的主要成分都是硅酸鹽 B.乙酸可用于環(huán)境消毒 C.使用含有氯化鈣的融雪劑會(huì)加速橋梁的腐蝕 D.沼氣是可再生資源,電能是二次能源 組卷:12引用:1難度:0.6 -
2.我國(guó)明代《余東錄》記載“鉛塊懸酒缸內(nèi),封閉四十九日,開(kāi)之則化為粉矣。化不白者,炒為黃丹。”涉及物質(zhì)轉(zhuǎn)化如下:Pb
(CH3COO)2Pbⅰ2Pb(OH)2?PbCO3ⅱPbO。下列有關(guān)說(shuō)法錯(cuò)誤的是( )ⅲA.鉛塊屬于金屬材料 B.2Pb(OH)2?PbCO3屬于堿式鹽 C.反應(yīng)ⅰ中(CH3COO)2Pb為氧化物 D.反應(yīng)iii為分解反應(yīng) 組卷:80引用:1難度:0.8 -
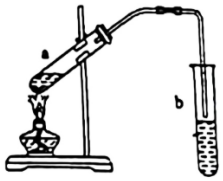 3.實(shí)驗(yàn)室制備少量乙酸乙酯的裝置如圖所示.下列有關(guān)該實(shí)驗(yàn)說(shuō)法正確的是( )
3.實(shí)驗(yàn)室制備少量乙酸乙酯的裝置如圖所示.下列有關(guān)該實(shí)驗(yàn)說(shuō)法正確的是( )A.反應(yīng)前,試管a中先加入濃硫酸,后加入適量冰酸醋和乙醇 B.乙酸乙酯易揮發(fā) C.試管b中應(yīng)盛放NaOH濃溶液 D.實(shí)驗(yàn)結(jié)束后,將試管b中混合液進(jìn)行蒸發(fā)結(jié)晶可得到乙酸乙酯 組卷:41引用:1難度:0.7 -
4.下列關(guān)于有機(jī)物的說(shuō)法正確的是(不考慮立體異構(gòu))( )
A.所有脂肪醛均符合通式CnH2nO B.乙醇、乙酸均能與NaHCO3反應(yīng).是因?yàn)榉肿又芯泄倌軋F(tuán)-OH C.分子式為C4H10O的有機(jī)物屬于醇類(lèi)的異構(gòu)體有4種 D.分子式為C4H7ClO2的羧酸有6種 組卷:6引用:1難度:0.7 -
5.下列事實(shí)不能用化學(xué)平衡移動(dòng)原理解釋的是( )
A.用排飽和食鹽水法收集氯氣 B.加催化劑,使SO2和O2在一定的條件下轉(zhuǎn)化為SO3 C.將NO2球浸泡在熱水中顏色加深 D.加壓條件下有利于N2和H2反應(yīng)生成NH3 組卷:21引用:1難度:0.7 -
6.設(shè)NA表示阿伏加德羅常數(shù)的值,下列說(shuō)法正確的是( )
A.2L0.2mol?L-1氯化銨溶液中加入氨水至溶液為中性,溶液含銨根離子數(shù)0.4NA B.在高溫高壓、催化劑的條件下,56gN2和12gH2充分反應(yīng),生成NH3的分子數(shù)為4NA C.用惰性電極電解KOH溶液,若陰極產(chǎn)生5.6L氣體,則電路中通過(guò)電子數(shù)為NA D.7g晶體硅中含有Si-Si鍵的數(shù)目為NA 組卷:8引用:1難度:0.7
二、非選擇題(共58分)
-
17.草酸亞鐵晶體受熱易分解,是一種淺黃色晶體,難溶于水.某化學(xué)興趣小組查文獻(xiàn)得出其熱分解方程式為FeC2O4?2H2O=FeO+CO↑+CO2↑+2H2O,然后根據(jù)文獻(xiàn)設(shè)計(jì)如圖1所示裝置,探究草酸亞鐵晶體(FeC2O4?2H2O)的分解反應(yīng)。
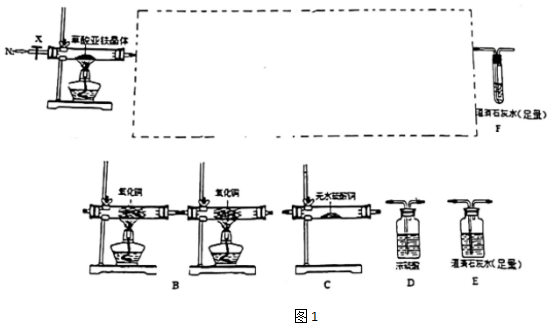
(I)實(shí)驗(yàn)裝置圖中間部分為B、C、D、E裝置,其正確連接順序是。其中檢驗(yàn)并保證除盡CO的裝置是(填字母)。
(2)設(shè)計(jì)實(shí)驗(yàn)步驟如下:
①檢查裝置的氣密性;
②打開(kāi)活塞x,通入一段時(shí)間的N2;
③先點(diǎn)燃處(填A(yù)或B)的酒精燈,再點(diǎn)燃處(壩A或B)的酒精燈。
(3)實(shí)驗(yàn)過(guò)程中,證明分解生成CO2的現(xiàn)象是。證明分解生成CO的現(xiàn)象是。
(4)草酸亞鐵中亞鐵離子的價(jià)電子排布式為,碳原子采用雜化。
(5)鐵和氨氣在640℃可發(fā)生置換反應(yīng),產(chǎn)物之一的晶胞結(jié)構(gòu)如圖2所示:
寫(xiě)出該反應(yīng)的化學(xué)方程式。若該晶體的密度是bg?cm-3,則兩個(gè)最近的Fe原子間的距離為cm.(阿伏加德羅常數(shù)用NA表示)組卷:10引用:1難度:0.6 -
18.工業(yè)上以乙苯催化脫氫制取苯乙烯的反應(yīng)如下:
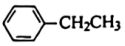 催化劑
催化劑 (g)+H2(g)△H。現(xiàn)將xmol乙苯蒸氣通入體積可變的密閉容器中反應(yīng),維持體系總壓強(qiáng)p總恒定.在某催化劑作用下,乙苯的平衡轉(zhuǎn)化率隨溫度變化如圖所示。
(g)+H2(g)△H。現(xiàn)將xmol乙苯蒸氣通入體積可變的密閉容器中反應(yīng),維持體系總壓強(qiáng)p總恒定.在某催化劑作用下,乙苯的平衡轉(zhuǎn)化率隨溫度變化如圖所示。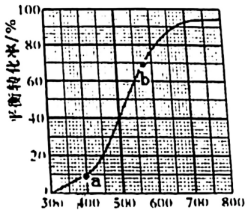
已知:①氣體分壓p分=氣體總壓(p總)×體積分?jǐn)?shù)。
②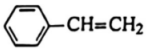 、H2、
、H2、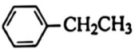 的燃燒熱ΔH分別為-akJ/mol、-bkJ/mol、-ckJ/mol。
的燃燒熱ΔH分別為-akJ/mol、-bkJ/mol、-ckJ/mol。
(1)上述反應(yīng)中,ΔH=kJ/mol(用含a、b、c的代數(shù)式表示)。
(2)500℃時(shí),10分鐘建立平衡,用單位時(shí)間內(nèi)物質(zhì)的量的改變表示平均反應(yīng)速率,則10分鐘內(nèi)v(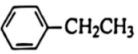 )=。
)=。
(3)a、b點(diǎn)的平衡常數(shù)KaKb(填“>”“<”或“=”),原因是。
(4)550℃時(shí),用平衡分壓代替平衡濃度表示的化學(xué)平衡常數(shù)Kp=。組卷:4引用:1難度:0.5


