2018-2019學年福建省龍巖一中高三(上)第一次模塊化學試卷(文科)
發布:2024/4/20 14:35:0
一、單選題(第1題至第4題每題2分;5題至18題每題3分)
-
1.央視欄目《國家寶藏》不僅介紹了歷史文化知識,彰顯了民族自信、文化自信,歷史文物本身也蘊含著許多化學知識。下列說法錯誤的是( )
A.戰國?曾侯乙編鐘屬于青銅制品,青銅是一種銅錫合金 B.南朝?《竹林七賢與啟榮期》磚畫的磚塊的主要成分是二氧化硅 C.清?乾隆“瓷母”-各種釉彩大瓶中的紅色窯變釉的主要成分是氧化亞銅 D.宋?王希孟《千里江山圖》卷中的綠色顏料銅綠的主要成分是堿式碳酸銅 組卷:83引用:8難度:0.9 -
2.下列關于化學與生活的認識不正確的是( )
A.水玻璃、堿石灰、漂白粉、福爾馬林、淀粉均為混合物 B.“地溝油”經加工處理后,可用于生產肥皂 C.安裝煤炭燃燒過程的“固硫”裝置,主要是為了提高煤的利用率 D.萃取在天然香料,藥物提取及核燃料處理等技術中得到了廣泛的應用 組卷:13引用:1難度:0.7 -
3.在給定條件下,下列選項所示的物質間轉化均能實現的是( )
A.Fe2O3(s) Fe(s)Al高溫FeCl3(aq)HCl(ap)B.Al(s) NaAlO2(aq)NaOH(ap)Al(OH)3(s)過量HCl(ap)C.AgNO3(aq) [Ag(NH3)2]+(aq)氨水Ag(s)蔗糖(ap)D.NaHCO3(s) Na2CO3(s)△NaOH(aq)飽和石灰水組卷:29引用:1難度:0.5 -
4.下列除雜質的方法不正確的是( )
A.鎂粉中混有少量鋁粉:加入過量燒堿溶液充分反應,過濾、洗滌、干燥 B.FeCl3溶液中混有少量AlCl3:加入過量的氨水,過濾洗滌沉淀,將沉淀再用適量鹽酸溶解 C.Fe2O3中混有少量Al2O3:加入過量NaOH溶液充分反應,過濾、洗滌、干燥 D.Al(OH)3中混有少量Mg(OH)2:加入足量燒堿溶液,充分反應,過濾,向濾液中通入過量CO2后過濾 組卷:107引用:7難度:0.7 -
5.下列指定反應的離子方程式正確的是( )
A.Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO B.向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- C.NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O D.Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O 組卷:18引用:1難度:0.6 -
6.用NA表示阿伏加德羅常數的值,下列敘述中正確個數的是( )
①2.24L氟化氫所含分子數約為0.1NA;
②常溫下,pH=2的醋酸溶液中所含有的H+數為0.01NA;
③密閉容器中2mol NO與1mol O2充分反應,產物的分子數為2NA;
④分子總數為NA的NO和CO混合氣體中含有的氧原子數為2NA;
⑤1L 1mol/L的磷酸溶液中含氧原子數為4NA;
⑥1mol FeCl3完全轉化成Fe(OH)3膠體后生成NA個膠粒;
⑦17g甲基(-14CH3)所含的中子數目為8NA;
⑧lLpH=1的H2SO4溶液中含有的H+數目大于0.2NA;
⑨足量鋅與一定量濃H2SO4反應,生成1mol氣體時轉移的電子數目為2NAA.2 B.3 C.4 D.5 組卷:48引用:1難度:0.7 -
7.下列有關物質的應用與性質相對應的說法正確的有幾個( )
①明礬能用于凈水是因為鋁離子水解生成的氫氧化鋁膠體具有強氧化性
②氯化鐵溶液可用于制作印刷電路板是因為其能氧化單質銅
③濃硫酸可用作干燥劑是因為其具有脫水性
④光導纖維可用作通訊材料是因為其具有導電性
⑤在食品袋中常常裝有CaO的透氣小袋是為了防止食品氧化
⑥鎂和鋁性質穩定且都有很強的抗腐蝕能力,所以鎂鋁合金可用于飛機、輪船制造
⑦Al具有良好的延展性和抗腐蝕性,可制成鋁箔包裝物品A.2個 B.3個 C.4個 D.5個 組卷:17引用:1難度:0.7
二、填空簡答題(共5小題,每小題5分,滿分50分)
-
22.醋酸鎳((CH3COO)2Ni]是一種重要的化工原料。一種以含鎳廢料(含NiS、Al2O3、FeO、CaO、SiO2)為原料,制取醋酸鎳的工藝流程圖如下:
相關離子生成氫氧化物的pH和相關物質的溶解性如表:
(1)NH4F的電子式為金屬離子 開始沉淀時的pH 沉淀完全時的pH 物質 20℃時溶解性(H2O) Fe3+ 1.1 3.2 CaSO4 微溶 Fe2+ 5.8 8.8 NiF 可溶 Al3+ 3.0 5.0 CaF2 難溶 Ni2+ 6.7 9.5 NiCO3 Ksp=1.0×10-5 。
(2)粉碎含鎳廢料的作用
(3)酸浸過程中,l molNiS失去6NA個電子,同時生成兩種無色有毒氣體。寫出該反應的化學方程式:。
(4)調節pH除鐵、鋁步驟中,溶液pH的調節范圍是。
(5)濾渣1和濾渣3主要成分的化學式分別是、。
(6)沉鎳過程中,若c(Ni2+)=2.0mol。L-1,欲使100mL該濾液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol?L-1],則需要加入Na2CO3固體的質量最少為g(保留一位小數)。
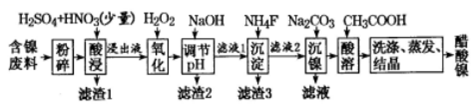
(7)保持其他條件不變,在不同溫度下對含鎳廢料進行酸浸,鎳浸出率隨時間變化如圖。酸浸的最佳溫度與時間分別為℃、min。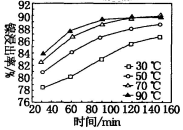 組卷:20引用:1難度:0.4
組卷:20引用:1難度:0.4 -
23.C、N、S的氧化物常會造成一些環境問題,科研工作者正在研究用各種化學方法來消除這些物質對環境的影響。
(1)目前工業上有一種方法是用CO2和H2在230℃,催化劑條件下轉化生成甲醇蒸汽和水蒸氣。圖一表示恒壓容器中0.5molCO2和1.5molH2轉化率達80%時的能量變化示意圖。寫出該反應的熱化學方程式。
(2)“亞硫酸鹽法”吸收煙氣中的SO2.室溫條件下,將煙氣通入(NH4)2SO3溶液中,測得溶液pH與含硫組分物質的量分數的變化關系如圖二所示。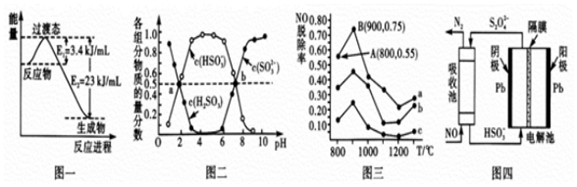
請寫出a點時n(HSO3-):n(H2SO3)=,b點時溶液pH=7,則n(NH4+):n(HSO3-)=。
(3)催化氧化法去除NO,一定條件下,用NH3消除NO污染,其反應原理為4NH3+6NO5N2+6H2O.不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:l、3:l、1:3時,得到NO脫除率曲線如圖三所示:催化劑
①曲線c對應NH3與NO的物質的量之比是。
②曲線a中NO的起始濃度為6×10-4mg/m3,從A點到B點經過0.8s,該時間段內NO的脫除速率為mg/(m3?s)。
(4)間接電化學法可除NO.其原理如圖四所示,寫出電解池陰極的電極反應式(陰極室溶液呈酸性,加入HSO3-,出來S2O42-):。組卷:13引用:1難度:0.5


