2022-2023學(xué)年浙江省溫州市環(huán)大羅山聯(lián)盟高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本大題共25小題,每小題2分,共50分。每個小題列出的四個備選項中只有一個是符合題目要求的,不進(jìn)、多選、錯選均不得分)
-
1.下列物質(zhì)中,水溶液顯酸性的鹽是( )
A.NaHCO3 B.H2S C.NaHSO4 D.Na2O2 組卷:4引用:1難度:0.7 -
2.下列物質(zhì)屬于非電解質(zhì)的是( )
A.NH3 B.H2O C.BaSO4 D.蔗糖溶液 組卷:7引用:1難度:0.7 -
3.在酸堿中和滴定實(shí)驗中,通常用不到下列儀器中的( )
A. 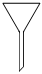
B. 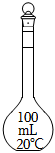
C. 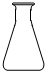
D. 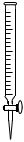 組卷:27引用:2難度:0.8
組卷:27引用:2難度:0.8 -
4.下列物質(zhì)在熔融狀態(tài)下不導(dǎo)電的是( )
A.Al2O3 B.CaCl2 C.Na2SO4 D.HCl 組卷:4引用:1難度:0.7 -
5.下列能量轉(zhuǎn)化過程與氧化還原反應(yīng)無關(guān)的是( )
A.天然氣燃燒時,將化學(xué)能轉(zhuǎn)化為熱能與光能 B.硅太陽能電池將光能轉(zhuǎn)化為電能 C.電解熔融NaCl制備鈉,電能轉(zhuǎn)化為化學(xué)能 D.原電池放電時,化學(xué)能轉(zhuǎn)化為電能 組卷:1引用:2難度:0.7 -
6.下列反應(yīng)既屬于氧化還原反應(yīng),又屬于吸熱反應(yīng)的是( )
A.灼熱的碳與CO2反應(yīng) B.Ba(OH)2?8H2O與NH4Cl反應(yīng) C.鐵與稀硫酸反應(yīng) D.甲烷在氧氣中燃燒 組卷:4引用:1難度:0.7 -
7.關(guān)于熱化學(xué)方程式S(s)+O2(g)═SO2(g)ΔH=-296kJ?mol-1,下列分析正確的是( )
A.1molS(s)與1molO2(g)的總能量比1molSO2(g)的能量低296kJ B.1個S(s)與1個O2(g)生成1個SO2(g)放出296kJ的熱量 C.反應(yīng)S(g)+O2(g)═SO2(g)的ΔH小于-296kJ?mol-1 D.反應(yīng)物的總鍵能大于生成物的總鍵能 組卷:28引用:2難度:0.7 -
8.下列說法或表示方法正確的是( )
A.需要加熱才能發(fā)生的反應(yīng)一定是吸熱反應(yīng) B.反應(yīng)H2(g)+Cl2(g)═2HCl(g)ΔH=-184.6kJ?mol-1,表示每摩爾反應(yīng)放出184.6kJ的熱量 C.氫氣與氧氣反應(yīng)生成等量的液態(tài)水和水蒸氣,后者放出的熱量多 D.已知2C(s)+2O2(g)═2CO2(g)ΔH1,2C(s)+O2(g)═2CO(g)ΔH2,則ΔH1>ΔH2 組卷:8引用:1難度:0.7 -
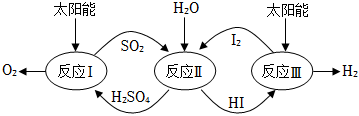 9.以太陽能為熱源,熱化學(xué)硫碘循環(huán)分解水是一種高效、環(huán)保的制氫方法,其流程圖如圖:
9.以太陽能為熱源,熱化學(xué)硫碘循環(huán)分解水是一種高效、環(huán)保的制氫方法,其流程圖如圖:
相關(guān)反應(yīng)的熱化學(xué)方程式為:
反應(yīng)Ⅰ:SO2(g)+I2(g)+2H2O(1)═2HI(aq)+H2SO4(aq)△H1=-213kJ?mol-1
反應(yīng)Ⅱ:H2SO4(aq)═SO2(g)+H2O(1)+O2(g)△H2=+327kJ?mol-112
反應(yīng)Ⅲ:2HI(aq)═H2(g)+I2(g)△H3=+172kJ?mol-1
下列說法不正確的是( )A.該過程實(shí)現(xiàn)了太陽能到化學(xué)能的轉(zhuǎn)化 B.SO2和I2對總反應(yīng)起到了催化劑的作用 C.總反應(yīng)的熱化學(xué)方程式為:2H2O(l)═2H2(g)+O2(g)△H=+286kJ?mol-1 D.該過程使水分解制氫反應(yīng)更加容易發(fā)生,但總反應(yīng)的△H不變 組卷:27引用:7難度:0.6
二、非選擇題(本大題共4小題,共50分)
-
28.酸堿中和反應(yīng)中溶液的pH變化可用于各種研究。
(1)用0.1000mol?L-1NaOH溶液分別滴定體積均為20.00mL、濃度均為0.1000mol?L-1的鹽酸和醋酸,得到滴定過程中溶液pH隨加入NaOH溶液體積變化的兩條滴定曲線(如圖所示)。
①NaOH溶液應(yīng)裝在如圖滴定管(填a或b)中,滴定醋酸的曲線是(填Ⅰ或Ⅱ)。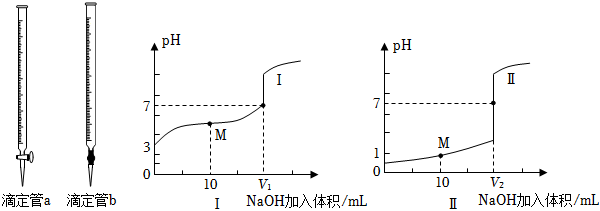
②滴定開始前,三種溶液中由水電離出的c(H+)最大的是。
③V1和V2的關(guān)系:V1V2(填“>”、“=”或“<”)。
(2)取20.00mL未知濃度的鹽酸放入錐形瓶中,并滴加2~3滴酚酞作指示劑,用0.10mol?L-1NaOH標(biāo)準(zhǔn)溶液進(jìn)行滴定。重復(fù)上述滴定操作2次,記錄數(shù)據(jù)如下。
①滴定時,右手實(shí)驗編號 NaOH溶液濃度(mol?L-1) 滴定完成消耗NaOH溶液的體積(mL) 鹽酸的體積(mL) 1 0.10 22.62 20.00 2 0.10 24.92 20.00 3 0.10 22.80 20.00 (填操作),達(dá)到滴定終點(diǎn)的標(biāo)志是。
②根據(jù)數(shù)據(jù)可計算出該鹽酸的濃度約為mol?L-1(保留兩位有效數(shù)字)。
③在上述實(shí)驗中,下列操作會造成所測鹽酸濃度偏高的有(填字母序號)。
A.滴定終點(diǎn)讀數(shù)時俯視
B.錐形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用待測鹽酸潤洗
D.堿式滴定管使用前,水洗后未用標(biāo)準(zhǔn)氫氧化鈉溶液潤洗
E.滴定前,堿式滴定管尖嘴部分有氣泡,滴定后氣泡消失組卷:18引用:1難度:0.6 -
 29.氫能源被視為21世紀(jì)最具發(fā)展?jié)摿Φ那鍧嵞茉矗澜缟显S多國家和地區(qū)廣泛開展了氫能源的研究。
29.氫能源被視為21世紀(jì)最具發(fā)展?jié)摿Φ那鍧嵞茉矗澜缟显S多國家和地區(qū)廣泛開展了氫能源的研究。
(1)氫氣熱值較高,是汽油的3倍,酒精的3.9倍。已知?dú)錃獾娜紵裏崾牵害=-285.8kJ?mol-1,則氫氣的熱值為kJ?g-1。
(2)煤的氣化是一種重要的制氫途徑。在一定溫度下,向體積固定的密閉容器中加入足量的C(s)和1molH2O(g),起始壓強(qiáng)為0.2MPa時,發(fā)生下列反應(yīng)生成水煤氣:
反應(yīng)Ⅰ:C(s)+H2O(g)?CO(g)+H2(g)ΔH1=+131.4kJ?mol-1
反應(yīng)Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)ΔH2=-41.1kJ?mol-1
反應(yīng)達(dá)到平衡時,H2O(g)的轉(zhuǎn)化率為50%,CO的物質(zhì)的量為0.1mol。
①有利于反應(yīng)Ⅰ自發(fā)進(jìn)行的條件是。
②下列說法正確的是。
A.平衡時向容器中充入?性氣體,反應(yīng)Ⅰ的平衡不移動
B.混合氣體的密度保持不變時,不能說明反應(yīng)體系已達(dá)到平衡
C.平衡時整個體系吸收31.2kJ能量
D.反應(yīng)Ⅱ的化學(xué)方程式前后物質(zhì)的化學(xué)計量數(shù)之和相等,所以反應(yīng)Ⅱ的ΔS=0
③平衡時,氣體的總物質(zhì)的量為mol,反應(yīng)Ⅰ的平衡常數(shù)Kp=MPa。[Kp:以氣體物質(zhì)的分壓p(B)替代濃度計算得到的平衡常數(shù),p(B)=p?x(B),p表示平衡時總壓,x(B)表示平衡系統(tǒng)中B的物質(zhì)的量分?jǐn)?shù)]
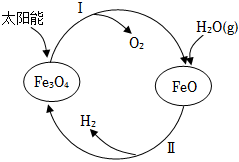
(3)用太陽能分解水制備H2是一項新技術(shù),其過程如圖所示。
已知:2H2O(g)═2H2(g)+O2(g)ΔH=akJ?mol-1
2Fe3O4(s)═6FeO(s)+O2(g)ΔH=bkJ?mol-1
①請寫出過程Ⅱ的熱化學(xué)方程式。
②請結(jié)合過渡態(tài)理論與碰撞理論解釋催化劑Fe3O4可加快水分解的原因。組卷:318引用:1難度:0.7


