2016-2017學年四川省成都外國語學校高二(上)入學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本小題包括20個小題,每小題2分,共40分.每小題只有一個選項符合題意.)
-
1.化學與科學、技術、社會、環境密切相關.下列有關說法中正確的是( )
A.朝鮮第三次核試驗產生的放射性物質的衰變為化學變化 B.燃燒化石燃料排放的廢氣中含大量CO2、SO2,形成酸雨 C.為防止垃圾污染城市,可采用露天焚燒或深埋的方法進行處理 D.用高純度二氧化硅制作的光導纖維遇強堿會“斷路” 組卷:11引用:2難度:0.9 -
2.下列有關化學用語表示正確的是( )
A.重氫原子: D21B.S2-的結構示意圖: 
C.質子數為53,中子數為78的碘原子: I13153D.N2的電子式:  組卷:16引用:1難度:0.9
組卷:16引用:1難度:0.9 -
3.下列氧原子的軌道表示式中,能量最低的是( )
A. 
B. 
C. 
D.  組卷:201引用:8難度:0.9
組卷:201引用:8難度:0.9 -
4.下列敘述正確的是( )
A. I放出射線是一個自發的化學變化過程,射線對人危害很大13153B.不同元素的原子構成的分子只含極性共價鍵 C.H2和T2是兩種不同的物質,互稱為同位素 D.短周期第ⅣA與ⅦA族元素的原子間構成的分子,均滿足原子最外層8電子結構 組卷:10引用:1難度:0.9 -
5.設NA表示阿伏加德羅常數的值.下列說法正確的是( )
A.一定條件下,0.2 mol SO2與足量O2充分反應,生成SO3分子數為0.2NA B.0.1 mol 中含有的電子數為0.9NANH-2C.3.4 g H2O2中含有的共用電子對數為0.1NA D.常溫常壓下,16 g O2和O3混合氣體含有的氧原子數為NA 組卷:2引用:1難度:0.9 -
6.下列說法中不正確的是( )
A.甲硫醇(CH3SH)比甲醇(CH3OH)的熔點低的原因是甲醇分子間易形成氫鍵 B.N-O鍵的極性比C-O鍵的極性小 C.氨易液化與氨分子間存在氫鍵有關 D.H2O是一種非常穩定的化合物,這是由于氫鍵所致 組卷:21引用:1難度:0.9 -
7.關于下列各裝置圖的敘述中,不正確的是( )
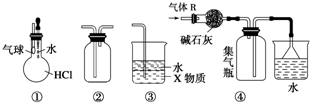
A.裝置①可驗證HCl氣體在水中的溶解性 B.裝置②可用于收集H2、NH3、Cl2、HCl、NO2、NO等 C.裝置③中X為四氯化碳,可用于吸收氨氣或氯化氫 D.裝置④可用于干燥、收集氨氣,并吸收多余的氨氣 組卷:14引用:8難度:0.9 -
8.根據泡利的原子軌道能級圖和“能級交錯”現象,原子軌道的能量高低順序是:ns<(n-3)g<(n-2)f<(n-1)d<np(n為能層序數,g能級中有9個軌道)。則未來的第八周期應包括的元素的種類是( )
A.32 B.50 C.64 D.128 組卷:394引用:4難度:0.7 -
9.下列各組離子一定能大量共存的是( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- B.Na2S溶液中:SO42-、K+、Cl-、Cu2+ C.0.1 mol?L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- D.在溶質為KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl- 組卷:4引用:1難度:0.7 -
10.元素周期表中ⅣA元素包括C、Si、Ge、Sn、Pb等,已知Sn的+4價穩定,而Pb的+2價穩定.結合所學知識,判斷下列反應中(反應條件略)正確的是( )
①Pb+2Cl2═PbCl4
②Sn+2Cl2═SnCl4
③SnCl2+Cl2═SnCl4
④PbO2+4HCl=PbCl4+2H2O
⑤Pb3O4+8HCl═3PbCl2+Cl2↑+4H2O.A.②③⑤ B.②③④ C.①②③ D.①②④⑤ 組卷:215引用:10難度:0.9 -
11.下列說法中錯誤的是( )
A.根據對角線規則,鈹和鋁的性質具有相似性 B.在H3O+、 和[Cu(NH3)4]2+中都存在配位鍵NH+4C.元素電負性越大的原子,吸引電子的能力越強 D.P4和CH4都是正四面體分子且鍵角都為109°28′ 組卷:57引用:20難度:0.9
三、填空題
-
34.為回收利用廢釩催化劑(含有V2O5、VOSO4及不溶性殘渣),科研人員最新研制了一種離子交換法回收釩的新工藝,主要流程如下:

部分含釩物質在水中的溶解性如下:
(1)圖中所示濾液中含釩的主要成分為物質 VOSO4 V2O5 NH4VO3 (VO2)2SO4 溶解性 可溶 難溶 難溶 易溶 (寫化學式).
(2)該工藝中反應③的沉淀率(又稱沉釩率)是回收釩的關鍵之一,該步反應的離子方程式;沉釩率的高低除受溶液pH影響外,還需要控制氯化銨系數(NH4Cl加入質量與料液中V2O5的質量比)和溫度.根據如圖判斷最佳控制氯化銨系數和溫度為和.
(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反應,以測定反應②后溶液中含釩量,完成反應的離子方程式為:□VO2++□H2C2O4+□=□VO2++□CO2↑+□H2O
(4)全礬液流電池的電解質溶液為VOSO4溶液,電池的工作原理為:VO2++V2++2H+VO2++H2O+V3+,電池放電時正極的電極反應式為放電充電.組卷:10引用:1難度:0.3 -
35.(1)捕碳技術(主要指捕獲CO2)在降低溫室氣體排放中具有重要的作用.目前NH3和(NH4)2CO3已經被用作工業捕碳劑,它們與CO2可發生如下可逆反應.

反應Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反應Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反應Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
則△H3與△H1、△H2之間的關系是:△H3=.
(2)白磷與氧氣反應生成P4O10固體.下表所示是部分化學鍵的鍵能參數:
根據圖1的分子結構和有關數據通過計算寫出該反應的熱化學方程式為化學鍵 P-P P-O P═O O═O 鍵能/kJ?mol-1 a b c d .
(3)三聚磷酸可視為三個磷酸分子(磷酸結構式如圖2)之間脫去兩個水分子產物,其結構式為,三聚磷酸鈉(俗稱“五鈉”)是常用的水處理劑,其化學式為.
(4)已知298K時白磷不完全燃燒的熱化學方程式為:P4(s,白磷)+3O2(g)═P4O6(s)△H=-1 638kJ?mol-1.
在某密閉容器中加入62g白磷和50.4L氧氣(標準狀況),控制條件使之恰好完全反應.則所得到的P4O10與P4O6的物質的量之比為.組卷:33引用:1難度:0.3


