2014-2015學年河北省衡水市武邑中學高二(上)周測化學試卷(11.9)
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意,共60分)
-
1.一種化學冰袋中含有Na2SO4?10H2O和NH4NO3,將它們混合并用手搓揉就可制冷,且制冷效果能維持一段時間.以下關(guān)于其制冷原因的推測,肯定錯誤的是( )
A.Na2SO4?10H2O脫水是吸熱過程 B.較長時間制冷是由于Na2SO4?10H2O脫水是較慢的過程 C.銨鹽在該條件下,發(fā)生的復分解反應(yīng)是吸熱反應(yīng) D.NH4NO3溶于水會吸收熱量 組卷:41引用:7難度:0.9 -
2.已知“凡氣體分子總數(shù)增多的反應(yīng)一定是熵增大的反應(yīng)”。根據(jù)所學知識判斷,下列反應(yīng)中,在所有溫度下都不自發(fā)進行的( )
A.2O3(g)═3O2(g)△H<0 B.2CO(g)═2C(s)+O2(g)△H>0 C.N2(g)+3H2(g)═2NH3(g)△H<0 D.CaCO3(s)═CaO(s)+CO2(g)△H>0 組卷:139引用:60難度:0.7 -
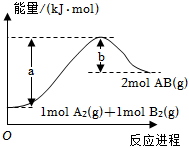 3.已知化學反應(yīng)A2(g)+B2(g)═2AB(g)的能量變化如圖所示,判斷下列敘述中正確的是( )
3.已知化學反應(yīng)A2(g)+B2(g)═2AB(g)的能量變化如圖所示,判斷下列敘述中正確的是( )A.每生成2分子AB吸收bkJ熱量 B.該反應(yīng)熱△H=+(a-b)kJ?mol-1 C.該反應(yīng)中反應(yīng)物的總能量高于生成物的總能量 D.斷裂1molA-A鍵和1molB-B鍵,放出akJ能量 組卷:377引用:44難度:0.9 -
4.升高溫度,下列數(shù)據(jù)不一定增大的是( )
A.化學反應(yīng)速率v B.水的離子積常數(shù)Kw C.化學平衡常數(shù)K D.弱酸的電離平衡常數(shù)Ki 組卷:36引用:13難度:0.9 -
5.已知膽礬溶于水時溶液溫度降低.膽礬分解的熱化學方程式為CuSO4?5H2O(s)═CuSO4(s)+5H2O(l)△H=+Q1 kJ?mol-1.室溫下,若1mol無水硫酸銅溶解為溶液放熱Q2 kJ,則( )
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.無法比較 組卷:364引用:13難度:0.9 -
6.可逆反應(yīng)2SO2+O2?2SO3的平衡狀態(tài)下,保持恒溫恒容向容器中加入一定量的O2,下列關(guān)于平衡體系的說法正確的是( )(K為平衡常數(shù),S為熵值)
A.S不變,K變大,O2轉(zhuǎn)化率增大 B.S不變,K變大,SO2轉(zhuǎn)化率減小 C.S變小,K不變,O2轉(zhuǎn)化率減小 D.S增大,K不變,SO2轉(zhuǎn)化率增大 組卷:59引用:1難度:0.7 -
7.某溫度下,將2mol A和3mol B充入一密閉容器中,發(fā)生反應(yīng):aA(g)+B(g)?C(g)+D(g),5min后達到平衡.已知該溫度下其平衡常數(shù)K=1,若溫度不變時將容器的體積擴大為原來的10倍,A的轉(zhuǎn)化率不發(fā)生變化,則( )
A.a(chǎn)=3 B.a(chǎn)=2 C.B的轉(zhuǎn)化率為40% D.B的轉(zhuǎn)化率為60% 組卷:69引用:26難度:0.7 -
8.恒溫下,向一帶活塞的密閉容器中充入2mol SO2和1mol O2,發(fā)生下列反應(yīng):2SO2(g)+O2(g)?2SO3(g)達到平衡后改變下述條件,SO3氣體平衡濃度不改變的是( )
A.保持容器體積不變,充入1molSO3(g) B.保持容器內(nèi)壓強不變,充入1molSO3(g) C.保持容器體積不變,充入1molO2(g) D.保持容器內(nèi)壓強不變,充入1molAr(g) 組卷:29引用:1難度:0.7
二、非選擇題:
-
 23.水的電離平衡曲線如圖所示.
23.水的電離平衡曲線如圖所示.
(1)若以A點表示25℃時水在電離平衡時的離子濃度,當溫度升到100℃時,水的電離平衡狀態(tài)到B點,則此時水的離子積從增加到.
(2)將100℃的恒溫下的pH=8的Ba(OH)2溶液與常溫下的pH=5的稀鹽酸混合,并保持100℃的恒溫,欲使混合溶液pH=7,則Ba(OH)2與鹽酸的體積比為.組卷:103引用:11難度:0.5 -
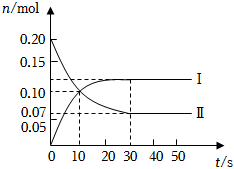 24.(1)在容積為2L的密閉容器中,保持體系內(nèi)溫度800℃不變,將一定量的NO和O2混合發(fā)生反應(yīng):2NO+O2?2NO2,其中NO的物質(zhì)的量(n)隨時間(t)的變化關(guān)系如圖所示,請回答下列問題.
24.(1)在容積為2L的密閉容器中,保持體系內(nèi)溫度800℃不變,將一定量的NO和O2混合發(fā)生反應(yīng):2NO+O2?2NO2,其中NO的物質(zhì)的量(n)隨時間(t)的變化關(guān)系如圖所示,請回答下列問題.
①圖象中曲線(選填“Ⅰ”或“Ⅱ”)表示NO2的變化.
②若升高反應(yīng)體系的溫度,使反應(yīng)重新達到平衡,此時體系中n(NO)=n(NO2),則該反應(yīng)是熱反應(yīng).
③在800℃時,若縮小容器的體積,達新平衡時n(NO)(選填“>”、“=”或“<”)0.07mol,NO的轉(zhuǎn)化率(選填“增大”、“不變”或“減小”)
(2)一定條件下,體積為1L的密閉容器中發(fā)生如下反應(yīng):SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ?mol-1
①下列各項中能說明該反應(yīng)已達化學平衡狀態(tài)的是(填字母序號)
a.v消耗(SiF4)=4v生成(HF) b.容器內(nèi)氣體壓強不再變化
c.容器內(nèi)氣體的總質(zhì)量不再變化 d.HF的體積分數(shù)不再變化
②反應(yīng)過程中測定的部分數(shù)據(jù)如下表(表中t2>t1)所示.
通過a或b的值及化學平衡原理判斷t1時反應(yīng)是否達到化學平衡狀態(tài)反應(yīng)時間/min n(SiF4)/mol n(H2O)/mol 0 1.20 2.40[ t1 0.80 a t2 b 1.60 .組卷:20引用:1難度:0.3


