2022-2023學年廣東省廣州中學高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一.選擇題(每小題只有一個正確答案,共10小題,每小題2分,計20分)
-
1.發明創造為人類文明進步做出了巨大貢獻。下列裝置工作時,涉及的能量轉化主要是化學能與電能之間的轉化 的是( )




A.新型太陽能路燈 B.“長征五號”遙四運
載火箭發射C.鉛酸蓄電池 D.煤氣灶 A.A B.B C.C D.D 組卷:74引用:5難度:0.8 -
2.化學知識廣泛應用于生活、生產中。下列敘述不正確的是( )
A.過氧乙酸和75%的乙醇都能殺死新冠病毒,二者消毒原理相同 B.電熱水器用鎂棒防止內膽腐蝕,原理是犧牲陽極的陰極保護法 C.用Na2S作沉淀劑,除去廢水中的Cu2+和Hg2+ D.草木灰與銨態氮肥混合施用會使肥效降低 組卷:14引用:1難度:0.6 -
3.下列圖示或化學用語表示不正確的是( )
A.  的空間結構模型CO2-3
的空間結構模型CO2-3B. 
SO2的VSEPR模型C. 
基態Cr的價層電子的軌道表示式D. 
px軌道的電子云輪廓圖組卷:78引用:2難度:0.6 -
4.下列各組離子,能在溶液中大量共存的是( )
A.水電離的c(H+)=1×10-12mol?L-1的溶液中:Na+、Mg2+、Cl-、NO3- B.AlCl3溶液中:Na+、K+、NO3-、CO32- C.pH=2的溶液:K+、Fe3+、CH3COO-、I- D.使甲基橙變紅的溶液:Mg2+、Na+、SO42-、NO3- 組卷:41引用:2難度:0.7 -
5.檸檬酸是天然防腐劑和食品添加劑,它是一種有機三元弱酸,與NaOH溶液反應生成檸檬酸鈉(用Na3Y表示)。下列說法正確的是( )
A.檸檬酸的電離方程式為:H3Y?3H++Y3- B.NaH2Y水溶液中:c(H2Y-)<c(Na+) C.Na3Y水溶液中:c(Na+)+c(H+)═3c(Y3-)+c(OH-) D.Na3Y水溶液的pH值隨著c(Na3Y)的增大而減小 組卷:124引用:2難度:0.6 -
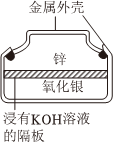 6.紐扣電池是一種攜帶方便的微型銀鋅電池,其結構如圖所示,下列有關說法錯誤的是( )
6.紐扣電池是一種攜帶方便的微型銀鋅電池,其結構如圖所示,下列有關說法錯誤的是( )A.電池工作時,電流從Ag2O極經過導線流到Zn極 B.電池工作一段時間后,電解質溶液的堿性減弱 C.Zn是電池的負極,發生氧化反應 D.電池工作時,正極反應式為Ag2O+H2O+2e-═2Ag+2OH- 組卷:231引用:1難度:0.5
三.非選擇題(包括4小題,共56分)
-
19.(1)氮是一種重要的元素,含氮化合物是化工、能源、環保等領域的研究熱點。回答下列問題:
①已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2N2(g)+2O2(g)?4NO(g)△H=+360kJ/mol
2H2(g)+O2(g)?2H2O(1)△H=-571.6kJ/mol
試寫出表示氨氣的燃燒熱的熱化學方程式:。
②若在一個容積為2L的密閉容器中加入0.2molN2的和0.6molH2的,在一定條件下發生反應:N2+3H2?2NH3ΔH<0,若在5分鐘時反應達到平衡,此時測得NH3的物質的量為0.2mol。則平衡時H2的轉化率為。
③從化學鍵的角度分析,化學反應的過程就是反應物的化學鍵的破壞和生成物的化學鍵的形成過程。
已知:N2(g)+3H2(g)═2NH3(g)ΔH=-93kJ?mol-1。試根據表中所列鍵能數據計算a的數值化學鍵 H-H N-H N≡N 鍵能/kJ?mol-1 436 a 945 。
(2)已知:合成尿素CO(NH2)2的反應為:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2(s)△H<0。向恒容密閉容器中按物質的量之比4:1充入NH3和CO2,使反應進行,保持溫度不變,測得CO2的轉化率隨時間的變化情況如圖所示。
①若用CO2的濃度變化表示反應速率,則A點的逆反應速率B點的正反應速率(填“>”“<”或“=”)。
②下列敘述中能說明該反應達到平衡狀態的是(填選項字母)。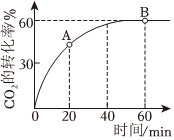
A.體系壓強不再變化
B.氣體平均摩爾質量不再變化
C.2v正(NH3)=v逆(H2O)
D.NH3和CO2的濃度之比為2:1
③工業上合成尿素時,既能加快反應速率,又能提高原料利用率的措施有(填選項字母)。
A.升高溫度
B.充入氮氣
C.將尿素及時分離出去
D.增大反應體系的壓強
(3)CO2催化轉化為甲醇是CO2回收利用的技術。向2L密閉容器中充入1molCO2和3molH2,在一定條件下,發生反應:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)ΔH<0。CO2的濃度隨時間(0~t2)變化如圖所示。其他條件不變,在t2時間將容器體積縮小至原來的一半,t3時重新達到平衡。請畫出t2~t4時段內CO2濃度的變化曲線。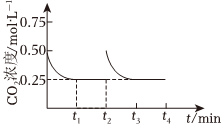 組卷:117引用:1難度:0.3
組卷:117引用:1難度:0.3 -
20.人類文明的發展歷程,也是化學物質的認識和發現的歷程。
(1)銅原子在基態時價電子排布式為。已知高溫下Cu2O比CuO更穩定,試從核外電子排布的角度解釋:。
(2)銅與類鹵素(SCN)2反應生成Cu(SCN)2,1mol(SCN)2中含有π鍵的數目為(阿伏加德羅常數的值用NA表示)。類鹵素(SCN)2對應的酸有兩種,理論上硫氰酸(H-S-C≡N)的沸點低于異硫氰酸(H-N=C=S)的沸點,其原因是。
(3)硝酸鉀中NO3-的空間結構為。
(4)6-氨基青霉烷酸的結構如圖甲所示,其中有出現sp3雜化的原子有(填寫元素符號)。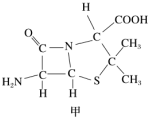
(5)H2Se、H2S、H2O的沸點由高到低的順序是,原因是。
(6)H+可與H2O形成H3O+,H3O+中H-O-H鍵角比H2O中H-O-H鍵角大,原因是。組卷:40引用:1難度:0.6


