2022-2023學年湖南省長沙市南雅中學高二(上)第三次月考化學試卷
發布:2024/10/5 9:0:2
一、單選題(本題共10小題,每小題3分,共30分。在每小題給出的四個選項中,只有一項是符合題目要求的。)
-
1.化學知識廣泛應用于生產、生活中,下列敘述不正確的是( )
A.純堿可以用作鍋爐除垢時CaSO4的轉化劑 B.“地溝油”禁止食用,但可用于生產肥皂 C.明礬和ClO2均可用作凈水劑,且凈水原理相同 D.為防止電池中的重金屬等污染土壤和水體,應積極開發廢電池的綜合利用技術 組卷:17引用:2難度:0.7 -
2.以下表示氦原子結構的化學用語中,對電子運動狀態描述最詳盡的是( )
A.He B. 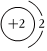
C.1s2 D. 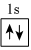 組卷:184引用:20難度:0.9
組卷:184引用:20難度:0.9 -
3.下列敘述中,不能用勒夏特列原理解釋的是( )
A.工業制取金屬鉀的反應為Na(l)+KCl(l)?NaCl(l)+K(g),選取適宜的溫度,使K變成蒸氣從反應混合物中分離出來,有利于反應向右進行 B.CO(g)+NO2(g)?CO2(g)+NO(g)達平衡后,增大壓強可使平衡體系顏色變深 C.工業上SO2催化氧化生成SO3,常通入過量的空氣來提高SO2的平衡轉化率 D.向含酚酞的Na2CO3溶液中滴加BaCl2溶液,紅色變淺 組卷:55引用:6難度:0.7 -
4.下列說法錯誤的是( )
A.ns電子的能量不一定低于(n+1)p電子的能量 B.基態6C的電子排布式1s22s22 違反了洪特規則p2xC.基態21Sc的電子排布式1s22s22p63s23p63d3違反了能量最低原理 D.基態22Ti的電子排布式1s22s22p63s23p10違反了泡利原理 組卷:23引用:5難度:0.7 -
5.在一容積不變,絕熱的密閉容器中發生可逆反應:2X(s)?Y(g)+Z(g),以下不能說明該反應達到化學平衡狀態的是( )
A.混合氣體的密度不再變化 B.反應容器中Y的質量分數不變 C.該反應的化學平衡常數不變 D.容器中混合氣體的平均相對分子量不變 組卷:19引用:3難度:0.7 -
6.室溫下,將兩種溶液等體積混合,若溶液混合引起的體積變化可忽略,下列各混合溶液中微粒物質的量濃度關系正確的是( )
A.0.1mol?L-1 HF(Ka=6.8×10?4)溶液和0.1mol?L-1 NaOH溶液混合:c(Na+)>c(OH-)>c(F-)>c(H+) B.0.1mol?L-1 NaHCO3溶液和0.1mol?L-1 Na2CO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) C.0.1mol?L-1 NaOH溶液和0.1mol?L-1H2C2O4(Ka1=5.4×10?2,Ka2=5.4×10?5)溶液混合:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) D.0.1mol?L-1 CH3COONa和0.1mol?L-1 HCl溶液混合:c(Na+)+c(CH3COO-)=c(Cl-)+c(H+) 組卷:140引用:2難度:0.6
三、非選擇題(每空2分,總54分)
-
17.合成氨技術的創立開辟了人工固氮的重要途徑,解決了億萬人口生存問題。回答下列問題:

(1)科學家研究利用鐵觸媒催化合成氨的反應歷程如圖所示,其中吸附在催化劑表面的物種用“ad”標記。由圖可知合成氨反應的熱化學方程式為,寫出該歷程中速率最慢一步的反應。
(2)工業合成氨反應為:N2(g)+3H2(g)?2NH3(g),當進料體積比V(N2):V(H2)=1:3時,平衡氣體中NH3的物質的量分數隨溫度和壓強變化的關系如圖所示:
①該反應的平衡常數K(a)K(b)(填“<”或“=”或“>”)。
②500℃、壓強為5P0時,Kp=[Kp為平衡分壓代替平衡濃度計算求得的平衡常數(分壓=總壓×物質的量分數)]。
(3)科學家利用生物燃料電池原理研究室溫下氨的合成并取得初步成果,電池工作時MV2+/MV+在電極與酶之間傳遞電子,示意圖如圖所示。
①A電極反應為。
②電池工作時在固氮酶表面發生的反應為。組卷:15引用:2難度:0.6 -
18.Ⅰ.用中和滴定法測定某燒堿的純度,試根據實驗回答:
(1)稱取4.1g燒堿樣品。將樣品配成250mL待測液,需要的主要玻璃儀器除燒杯、玻璃棒、膠頭滴管外還需。
(2)取10.00mL待測液,用量取。
(3)用0.2010mol?L-1標準鹽酸滴定待測燒堿溶液,以酚酞為指示劑,滴定時左手旋轉酸式滴定管的玻璃活塞,右手不停地搖動錐形瓶,直到看到即可判斷達到滴定終點。
(4)根據表中數據,計算樣品燒堿的質量分數為(結果保留四位有效數字)。(假設燒堿中不含有與酸反應的雜質)
(5)滴定過程,下列情況會使測定結果偏高的是滴定次數 待測液體積(mL) 標準鹽酸體積(mL) 滴定前讀數(mL) 滴定后讀數(mL) 第一次 10.00 0.50 20.40 第二次 10.00 4.00 24.10 (填序號)。
①記錄起始體積時,仰視讀數,終點時俯視;
②堿式滴定管水洗后,就用來量取待測液;
③滴定前,酸式滴定管有氣泡,滴定后消失;
④滴定過快成細流、將堿液濺到錐形瓶壁而又未搖勻洗下;
⑤鹽酸在滴定時濺出錐形瓶外;
Ⅱ.室溫下,向20.00mL未知濃度的二元酸H2B中,逐滴加入0.1000mol?L-1的NaOH溶液,用pH計測定溶液的pH,左側縱軸表示混合溶液中各微粒的物質的量分數,相關數據如圖所示(曲線③為滴定曲線)。
(1)H2B的一級電離方程式為:。
(2)B2-的水解常數=。組卷:14引用:1難度:0.5


