2022年湖北省武漢市黃陂第七高級中學高考化學五模試卷
發布:2024/4/20 14:35:0
選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.為實現2030年碳達峰的目標,必須大力開發新型能源。下列四組選項中,全部符合圖中陰影部分的能源是( )
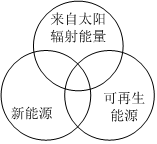
A.煤炭、石油、沼氣 B.水能、生物能、天然氣 C.太陽能、風能、生物質能 D.地熱能、海洋能、火電能 組卷:33引用:5難度:0.8 -
2.《集玄方》中治齒疏陷物的中藥方:“爐甘石(注:ZnCO3)、寒水石(注:CaSO4)等分,為末。每用少許擦牙,忌用刷牙,久久自密。”下列有關說法錯誤的是( )
A.Zn位于元素周期表中的ds區 B.Ca的價層電子排布式為4s2 C.SO42-的鍵角為109°28' D.CO32-的空間結構為三角錐形 組卷:42引用:3難度:0.7 -
3.下列有關物質的應用錯誤的是( )
A.CuO可以代替Fe3O4作打印機墨粉 B.回收和利用CO2,有助于我國早日實現“碳中和” C.聚苯乙烯耐各種堿、鹽及水溶液,可用來制作塑料制品 D.半導體材料砷化鎵可以用于制造太陽能電池板 組卷:13引用:3難度:0.8 -
4.實驗室中提取碘的流程如圖所示,流程中步驟A~D對應的裝置正確的是( )





A B C D A.A B.B C.C D.D 組卷:6引用:1難度:0.5 -
5.四乙烯基甲烷的結構如圖(
 ),下列說法正確的是( )
),下列說法正確的是( )A.四乙烯基甲烷和[3]軸烯(  )互為同系物
)互為同系物B.四乙烯基甲烷與丙苯互為同分異構體 C.四乙烯基甲烷的二氯代物有4種 D.四乙烯基甲烷分子中所有碳原子有可能共平面 組卷:102引用:2難度:0.6 -
 6.在普通鋁中加入少量Cu和Mg后,形成一種稱為拉維斯相的MgCu2(結構如圖)微小晶粒,其分散在Al中可使得鋁材的硬度增加、延展性減小,形成所謂“堅鋁”,“堅鋁”是制造飛機的主要材料。已知:該結構中Mg以金剛石方式堆積,八面體空隙和半數的四面體空隙中填入以四面體方式排列的Cu。則晶體結構中鎂原子之間的最短距離為( )
6.在普通鋁中加入少量Cu和Mg后,形成一種稱為拉維斯相的MgCu2(結構如圖)微小晶粒,其分散在Al中可使得鋁材的硬度增加、延展性減小,形成所謂“堅鋁”,“堅鋁”是制造飛機的主要材料。已知:該結構中Mg以金剛石方式堆積,八面體空隙和半數的四面體空隙中填入以四面體方式排列的Cu。則晶體結構中鎂原子之間的最短距離為( )A. 24apmB. 34apmC. 22apmD. 32apm組卷:63引用:4難度:0.5
非選擇題:本題共4小題,共55分。
-
18.三氯化硼(BCl3)用于制備光導纖維和有機硼化物等,制備原理:B2O3+3C+3Cl2
2BCl3+3CO。某小組據此設計實驗制備BCl3并測定其純度,裝置如圖:△
已知:BCl3的熔點為-107.3℃,沸點為12.5℃,極易水解產生H3BO3[或B(OH)3]和HCl。
實驗(一):制備BCl3。
(1)水浴R選擇(填“熱水浴”或“冰水浴”),裝堿石灰的儀器是(填名稱)。
(2)F裝置的作用是。
(3)已知:A裝置中還原產物為Cr3+,其離子方程式為。
實驗(二):探究BCl3的性質。
據文獻資料顯示,BCl3在乙醇中劇烈反應生成硼酸酯和“白霧”,與BCl3在水中發生水解相似。
(4)寫出三氯化硼與乙醇反應的化學方程式:。
實驗(三):測定BCl3產品的純度。
①準確稱取wg產品,置于蒸餾水中,完全水解,并配成250mL溶液。
②準確量取25.00mL溶液于錐形瓶中。
③向其中加入V1mLc1mol?L-1AgNO3溶液至沉淀完全,然后加入3mL硝基苯(常溫常壓下,密度為1.205g?cm-3)。
④向錐形瓶中滴加3滴FeCl3溶液,然后逐滴加入c2mol?L-1KSCN標準溶液滴定過量的AgNO3溶液,消耗KSCN溶液的體積為V2mL。已知:Ksp(AgCl)>Ksp(AgSCN)。
(5)步驟③加入硝基苯的目的是包住AgCl沉淀,若不加硝基苯,則滴定時消耗KSCN標準溶液的體積可能(填“偏大”或“偏小”);滴定終點時的現象是。
(6)該產品中BCl3的質量分數為%;如果其他操作都正確,僅滴定管沒有用KSCN溶液潤洗,測得產品中BCl3的質量分數(填“偏高”、“偏低”或“無影響”)。組卷:40引用:2難度:0.4 -
19.丙烯是制備聚丙烯的單體,在催化劑作用下,可由丙烷直接脫氫或氧化脫氫制得。
反應I(直接脫氫):C3H8(g)?C3H6(g)+H2(g)ΔH1
反應II(氧化脫氫):2C3H8(g)+O2(g)?2C3H6(g)+2H2O(g)ΔH2=-236kJ?mol-1
已知:2H2(g)+O2(g)?2H2O(g)ΔH3=-484kJ?mol-1
(1)ΔH1=kJ?mol-1。
(2)向某容器中僅通入C3H8(g),發生反應I,達到平衡后,下列措施能提高C3H6(g)的平衡產率的有(填標號)。
A.恒壓下,充入惰性氣體
B.加入高效催化劑
C.恒容下,充入C3H8
D.適當升高溫度
(3)向某恒壓密閉容器中通入C3H8(g)和N2(g)的混合氣體(N2不參與反應),反應起始時氣體的總壓強為100 kPa。在溫度為T1°C時,C3H8(g)的平衡轉化率與通入的混合氣體中C3H8(g)的物質的量分數的關系如圖1所示。
①C3H8的平衡轉化率隨起始通入C3H8的物質的量分數增大而減小,其原因是。
②T0℃時,反應I的平衡常數Kp=(以分壓表示,分壓=總壓×物質的量分數,保留一位小數)kPa。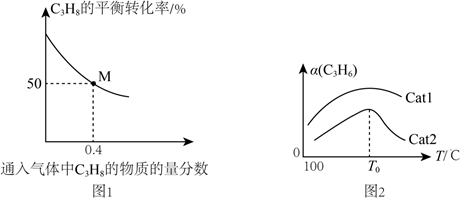
(4)向密閉容器中充入一定量丙烷,在催化劑Cat1、Cat2作用下,單位時間內丙烯的產率與溫度的關系如圖2所示。在相同條件下,催化效率較高的是(填“Cat1”或“Cat2”)。在Cat2作用下,T0℃之后丙烯產率急劇減小的原因可能是(答一條)。
(5)恒溫剛性密閉容器中通入氣體分壓比為p(C3H8):p(O2):p(N2)=2:13:85的混合氣體,已知:某反應條件下僅發生如下反應(k、k′為速率常數):
反應II:2C3H8(g)+O2(g)?2C3H6(g)+2H2O(g)k
反應III:2C3H6(g)+9O2(g)?6CO2(g)+6H2O(g)k′
實驗測得丙烯的凈生成速率方程為v(C3H6)=kp(C3H8)-k′p(C3H6),可推測丙烯的濃度隨時間的變化趨勢為。
(6)已知:高溫下,C-C鍵斷裂的反應比C-H鍵斷裂的脫氫反應容易發生,這將導致C3H6的選擇性降低;同時高溫加劇催化劑表面積炭,導致催化劑迅速失活。在生產中充入CO2的作用之一是利于保持催化劑活性,其原因是(用化學方程式表示)。組卷:34引用:2難度:0.7


