2022-2023學年黑龍江省哈爾濱九中高一(上)月考化學試卷(11月份)
發布:2024/12/5 0:30:2
一、單項選擇題(本題包括20小題,每題2分,共40分)
-
1.下圖是常見與實驗有關圖標,下列說法錯誤的是( )
A. 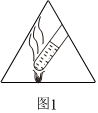
圖1代表禁煙,實驗工作區域內禁止吸煙,尤其是產生易燃易爆氣體的實驗B. 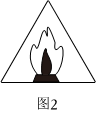
圖2代表明火,實驗過程中應正確使用火源,并束好長發、系緊寬松衣物C. 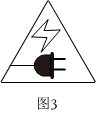
圖3代表用電,禁止濕手操作,實驗結束切斷電源D. 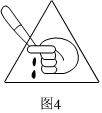
圖4代表銳器,實驗過程中應規范實驗操作,避免將銳器指向自己或他人組卷:15引用:1難度:0.7 -
2.膠體在日常生活中經常接觸,下列常見的物質屬于膠體的是( )
①石灰乳
②水
③稀豆漿
④普通玻璃
⑤FeCl3溶液
⑥云、霧A.②④⑤ B.③⑥ C.①④⑥ D.①⑥ 組卷:6引用:1難度:0.7 -
3.物質分類有多種角度,從不同角度對CO2進行歸類,CO2不屬于下列哪類物質( )
A.酸性氧化物 B.污染物 C.氣體 D.非電解質 組卷:10引用:1難度:0.8 -
4.下列說法正確的是( )
A.電解質的電離不僅需要水溶液或熔融狀態,還需要通電 B.物質熔化是吸熱過程,溶解是放熱過程 C.由同種元素組成的物質是純凈物 D.電解質在溶液中的反應實質上是離子之間的反應 組卷:4引用:1難度:0.7 -
5.關于反應KIO3+6HI═KI+3I2+3H2O,下列說法正確的是( )
A.KIO3發生氧化反應 B.KI是還原產物 C.生成1molI2時,轉移 mol電子53D.還原劑與氧化劑的物質的量之比為1:6 組卷:21引用:1難度:0.5 -
6.設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.標準狀況下,44.8LCCl4所含分子數為2NA B.1L1.0mol/L的鹽酸含有陰離子總數為2NA C.11.2LCO與11.2LO2混合后的氣體分子數目為NA D.2.3gNa與足量H2O反應生成的H2分子數目為0.05NA 組卷:12引用:1難度:0.7 -
7.NaH與水發生反應:NaH+H2O═NaOH+H2↑。現將0.1molNaH與適量的水完全反應,得到100mL溶液。設NA為阿伏加德羅常數的值。下列說法錯誤的是( )
A.該反應中NaH失去電子的數目為0.2NA B.0.1molNaH固體中,質子數為1.2NA C.所得溶液中OH-濃度為1mol/L D.該反應中產生H2的體積約為2.24L(標準狀況) 組卷:26引用:1難度:0.6 -
8.下列解釋事實的方程式錯誤的是( )
A.用小蘇打治療胃酸過多:HCO3-+H+═CO2↑+H2O B.氫氧化鈉溶液吸收氯氣:Cl2+2OH-═Cl-+ClO-+H2O C.鐵和稀硫酸反應:2Fe+6H+═2Fe3++3H2↑ D.氫氧化鋇溶液與過量硫酸氫鈉溶液混合:SO42-+Ba2++2H++2OH-═2H2O+BaSO4↓ 組卷:26引用:1難度:0.5 -
9.類比推理是研究物質性質的常用方法,可預測許多物質的性質,但類比是相對的,不能違背客觀實際。下列說法中正確的是( )
A.NaHSO4溶液顯酸性,NaHCO3溶液也顯酸性 B.少量CO2通入Ba(OH)2溶液中產生白色沉淀,則少量CO2通入BaCl2溶液也產生白色沉淀 C.碳酸氫鈉受熱易分解,碳酸氫鈣受熱也易分解 D.CaO是堿性氧化物,Al2O3也是堿性氧化物 組卷:10引用:1難度:0.8
三、非選擇題
-
28.實驗室模擬工業上以石灰石和海水為原料制取漂白粉的流程如圖所示:
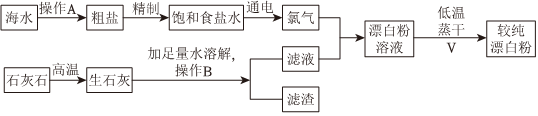
請回答下列問題:
(1)實驗室中操作A的名稱為。
(2)操作B和操作C中都要使用玻璃棒,其作用依次是、。
(3)氯氣與濾液反應生成漂白粉溶液的化學方程式為。
(4)操作C采用低溫蒸干的原因可能是。
(5)寫出電解飽和食鹽水的化學方程式,分析此處食鹽水采用飽和的原因:。組卷:53引用:2難度:0.6 -
 29.某學生利用高錳酸鉀分解制氧氣的反應,測定室溫下的氣體摩爾體積,實驗裝置如圖。
29.某學生利用高錳酸鉀分解制氧氣的反應,測定室溫下的氣體摩爾體積,實驗裝置如圖。
實驗步驟:
①裝好實驗裝置;
②;
③把適量高錳酸鉀粉末放入干燥的試管中,準確稱量試管和高錳酸鉀粉末的質量為ag;
④加熱,開始反應,直到產生一定量的氣體;
⑤停止加熱;
⑥測量收集到的氣體的體積;
⑦準確稱量試管和殘留物的質量為bg;
⑧測量實驗室的溫度。
請回答下列問題:
(1)實驗步驟的第②步是。
(2)以下是測量收集到的氣體的體積時必須包括的幾個步驟:
①調整量氣管高度,使其液面高度與水準管液面高度相平;
②使裝置內的氣體都冷卻至室溫;
③讀取量氣管中氣體的體積;
這三步操作的正確順序是→→③(請填寫步驟代號)。
(3)如果實驗中得到的氧氣體積是cL,水蒸氣的影響忽略不計,則室溫下氣體摩爾體積的計算式為L/mol(含a、b、c)。
(4)假定其他操作均正確,分析下列因素對實驗結果的影響。
①高錳酸鉀未完全分解:(填“偏大”、“偏小”或“無影響”,下同);
②實驗前未將裝置內的空氣排出:;
③未恢復至室溫就讀數:。組卷:50引用:1難度:0.8


