2023-2024學年北京市海淀區高二(上)期中化學練習試卷
發布:2024/10/12 6:0:3
一、選擇題(本題共14道小題,每小題3分,共42分。每小題只有一個選項符合題意)
-
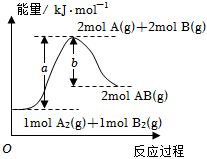 1.反應A2(g)+B2(g)═2AB(g)的能量變化示意圖如圖所示。下列說法正確的是( )
1.反應A2(g)+B2(g)═2AB(g)的能量變化示意圖如圖所示。下列說法正確的是( )A.1molA2(g)和1molB2(g)的內能之和為akJ B.該反應每生成2個AB分子,吸收能量(a-b)kJ C.該反應每生成1molAB,放出能量bkJ D.反應A2(g)+B2(s)═2AB(g)ΔH=xkJ?mol-1,則x>(a-b) 組卷:187引用:7難度:0.5 -
2.用如圖裝置進行鐵的電化學腐蝕實驗。下列說法正確的是( )一段時間后,左側試管發熱,導管口有氣泡產生。
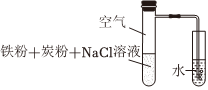
A.鐵發生的電極反應:Fe-3e-═Fe3+ B.鐵腐蝕過程中,化學能轉化為熱能 C.炭粉的存在對鐵腐蝕的速率無影響 D.導管口產生氣泡證明鐵發生了析氫腐蝕 組卷:79引用:2難度:0.7 -
3.已知反應:①CH4(g)+2F2(g)═CH2F2(g)+2HF(g)ΔH1<0
②CH4(g)+4F2(g)═CF4(g)+4HF(g)ΔH2
相關化學鍵的鍵能數據如下:
下列說法正確的是( )化學鍵 C-H C-F H-F F-F 鍵能/(kJ?mol-1) a b c d A.①中反應物的總能量小于生成物的總能量 B.ΔH1=2(b-a+c-d)kJ?mol-1 C.ΔH2= ΔH112D.CH2F2(g)+2F2(g)═CF4(g)+2HF(g)ΔH=ΔH2-ΔH1 組卷:140引用:8難度:0.5 -
 4.某種培根型堿性氫氧燃料電池示意圖如圖所示,下列有關該電池的說法不正確的是( )
4.某種培根型堿性氫氧燃料電池示意圖如圖所示,下列有關該電池的說法不正確的是( )A.電池放電時,K+向鎳電極Ⅰ的方向遷移 B.正極電極反應為:O2+2H2O+4e-═4OH- C.出口Ⅰ處有水生成 D.循環泵可使電解質溶液不斷濃縮、循環 組卷:107引用:2難度:0.6 -
5.M與N在密閉容器中反應生成P,其反應速率分別用v(M)、v(N)、v(M)表示。已知v(M)、v(N)、v(M)之間有以下關系:4v(M)=5v(N)、v(N)=2v(P),則此反應可表示為( )
A.4M+5N=2P B.4M+5N=8P C.5M+4N=2P D.5M+4N=8P 組卷:21引用:1難度:0.5 -
6.室溫下,用0.1mol?L-1Na2S2O3溶液0.1mol?L-1H2SO4溶液和蒸餾水進行如下表所示的5個實驗,分別測量渾濁度隨時間的變化。
下列說法不正確的是( )編號 Na2S2O3溶液 H2SO4溶液 蒸餾水 渾濁度隨時間變化的曲線 V/mL V/mL V/mL 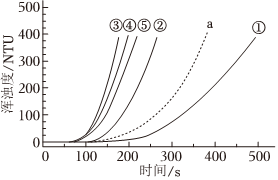
① 1.5 3.5 10 ② 2.5 3.5 9 ③ 3.5 3.5 x ④ 3.5 2.5 9 ⑤ 3.5 1.5 10 A.實驗③中x=8 B.實驗①②③或③④⑤均可說明其他條件相同時,增大反應物濃度可增大該反應速率 C.降低Na2S2O3溶液濃度比降低H2SO4溶液濃度對該反應化學反應速率影響程度更大 D.將裝有實驗②的試劑的試管浸泡在熱水中一段時間后再混合,其渾濁度曲線應為a 組卷:339引用:8難度:0.5
二、填空題(本題共5道小題,共58分)
-
18.紅礬鈉(Na2Cr2O7?2H2O)可用于制備制革產業中的鉻鞣劑。對含鉻污泥進行酸浸處理后,得到浸出液(主要含Na+、Ni2+、Cr3+、H+、Cr2
和O2-7),經過如下主要流程,可制得紅礬鈉,實現鉻資源的有效循環利用。SO2-4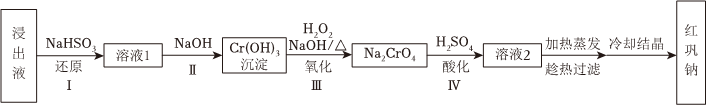 已知:i.Cr(VI)溶液中存在以下平衡:Cr2+H2O?2O2-7+2H+CrO2-4
已知:i.Cr(VI)溶液中存在以下平衡:Cr2+H2O?2O2-7+2H+CrO2-4
ii.相關金屬離子形成氫氧化物沉淀的pH范圍如下:
(1)Ⅱ中,加入NaOH調節pH至金屬離子 開始沉淀的pH 沉淀完全的pH Cr3+ 4.3 5.6 Ni2+ 7.1 9.2 (填字母序號)。
a.4.3~5.6
b.4.3~7.1
c.5.6~7.1
d.7.1~9.2
(2)Ⅲ中,H2O2氧化Cr(OH)3沉淀的化學方程式為。
(3)Ⅲ中,在投料比、反應時間均相同時,若溫度過高,Na2CrO4的產率反而降低,可能的原因是。
(4)Ⅳ中,加入H2SO4的作用是(結合平衡移動原理解釋)。
(5)為了測定獲得紅礬鈉(Na2C2O7?2H2O)的純度,稱取上述流程中的產品ag配成100mL溶液,取出25mL放于錐形瓶中,加入稀硫酸和足量的KI溶液,置于喑處充分反應至Cr2全部轉化為Cr3+后,滴入2~3滴淀粉溶液,最后用濃度為c1mol?L-1的Na2S2O3標準溶液滴定,共消耗V1mL。O2-7
(已知:I2+2S2═2I-+S4O2-3)O2-6
①滴定終點的現象為。
②所得Na2Cr2O7?2H2O(摩爾質量為298g?mol-1)的純度的表達式為(用質量分數表示)。組卷:14引用:4難度:0.4 -
19.2KMnO4+5H2C2O4+6H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O反應為例,探究濃度對反應速率的影響。(實驗中不加任何指示劑,且不使用計時器。)
(1)甲同學設計了如下方案: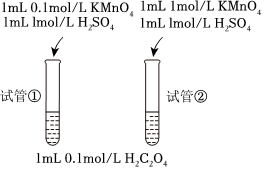
乙認為該同學設計的方案存在問題,問題是
(2)乙同學改進了方案并進行實驗: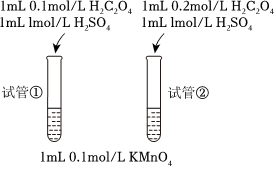
該同學實驗未成功,失敗的原因是
(3)丙同學設計改進了如下方案: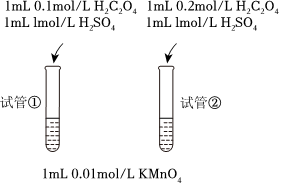
實驗現象為,由此得到的實驗結論為。
(4)丁同學也設計了如下方案: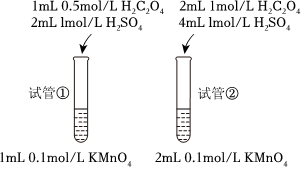
請分析該同學分析是否可行,請說明理由
(5)王同學設計了如下方案: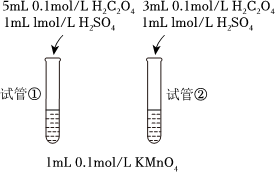
該同學的實驗方案如果成立,需要在試管中加入。
【反思】
(6)本實驗想成功探究濃度對反應速率的影響,滿足的條件為:
a.
b.
【遷移應用】
(7)欲探究Fe3+、Cu2+對H2O2分解的催化效果(已知Cl-、對反應均無催化作用)。請設計實驗:SO2-4
a;
b;
c;
d。組卷:13引用:1難度:0.5


