人教版(2019)選擇性必修1《2.1 化學(xué)反應(yīng)速率》2023年同步練習(xí)卷(10)
發(fā)布:2024/8/16 20:0:2
一、選擇題
-
1.下面有關(guān)化學(xué)反應(yīng)速率的說(shuō)法中正確的是( )
A.對(duì)任何化學(xué)反應(yīng)來(lái)說(shuō),反應(yīng)速率越大,反應(yīng)現(xiàn)象就越明顯 B.化學(xué)反應(yīng)速率通常用單位時(shí)間內(nèi)任何一種反應(yīng)物濃度的減少或任何一種生成物濃度的增加來(lái)表示 C.若某化學(xué)反應(yīng)的反應(yīng)速率為0.5mol?(L?s)-1,就是指在該時(shí)間內(nèi)反應(yīng)物和生成物的濃度變化都為0.5mol?(L?s)-1 D.化學(xué)反應(yīng)速率是用來(lái)衡量化學(xué)反應(yīng)進(jìn)行快慢的物理量 組卷:1147引用:11難度:0.3 -
2.某溫度下,反應(yīng)2N2O5=4NO2+O2開始進(jìn)行時(shí),c(N2O5)=0.0408mol/L.經(jīng)1min后,c(N2O5)=0.030mol/L.則該反應(yīng)的反應(yīng)速率是( )
A.v(N2O5)=1.8×10-4mol?L-1?s-1 B.v(N2O5)=1.8×10-2mol?L-1?s-1 C.v(NO2)=1.8×10-4mol?L-1?s-1 D.v(O2)=1.8×10-4mol?L-1?s-1 組卷:34引用:8難度:0.9 -
3.在一密閉容器中進(jìn)行反應(yīng)6M(s)+2N(g)?3P(g)+Q(g),經(jīng)4min后,N的濃度從1.6mol/L減少至0.4mol/L.下列反應(yīng)速率的表示正確的是( )
A.用M表示的反應(yīng)速率是0.9mol/(L?min) B.用N表示的反應(yīng)速率是0.3mol/(L?min) C.4 min末的反應(yīng)速率,用P表示是0.45mol/(L?min) D.任意時(shí)刻均有2v(N)=3v(P) 組卷:98引用:3難度:0.7 -
4.以反應(yīng) 5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O 為例探究“外界條件對(duì)化學(xué)反應(yīng)速率的影響”。實(shí)驗(yàn)時(shí),分別量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并開始計(jì)時(shí),通過測(cè)定溶液褪色所需時(shí)間來(lái)判斷反應(yīng)的快慢。下列說(shuō)法不正確的是( )
編號(hào) H2C2O4溶液 酸性KMnO4溶液 溫度/℃ 濃度/mol?L-1 體積/mL 濃度/mol?L-1 體積/mL ① 0.10 2.0 0.010 4.0 25 ② 0.20 2.0 0.010 4.0 25 ③ 0.20 2.0 0.010 4.0 50 A.實(shí)驗(yàn)①、②、③所加的H2C2O4溶液均要過量 B.實(shí)驗(yàn)①和實(shí)驗(yàn)②是探究濃度對(duì)化學(xué)反應(yīng)速率的影響,實(shí)驗(yàn)②和③是探究溫度對(duì)化學(xué)反應(yīng)速率的影響 C.實(shí)驗(yàn)①和②起初反應(yīng)均很慢,過了一會(huì)兒速率突然增大,可能是生成的Mn2+對(duì)反應(yīng)起催化作用 D.若實(shí)驗(yàn)①測(cè)得 KMnO4溶液的褪色時(shí)間為40s,則這段時(shí)間內(nèi)平均反應(yīng)速率v(KMnO4)=2.5×10-4mol?L-1?s-1 組卷:112引用:16難度:0.4 -
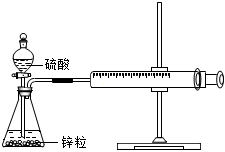 5.某溫度下按如圖安裝好實(shí)驗(yàn)裝置,在錐形瓶?jī)?nèi)盛6.5g鋅粒(顆粒大小基本相同),通過分液漏斗加入40mL 2.5mol?L-1的硫酸溶液,將產(chǎn)生的H2收集在一個(gè)注射器中,用時(shí)10s時(shí)恰好收集到氣體的體積為50mL(若折合成0℃、101 kPa條件下的H2體積為44.8mL),在該溫度下,下列說(shuō)法不正確的是( )
5.某溫度下按如圖安裝好實(shí)驗(yàn)裝置,在錐形瓶?jī)?nèi)盛6.5g鋅粒(顆粒大小基本相同),通過分液漏斗加入40mL 2.5mol?L-1的硫酸溶液,將產(chǎn)生的H2收集在一個(gè)注射器中,用時(shí)10s時(shí)恰好收集到氣體的體積為50mL(若折合成0℃、101 kPa條件下的H2體積為44.8mL),在該溫度下,下列說(shuō)法不正確的是( )A.可以通過測(cè)定鋅粒減少質(zhì)量來(lái)測(cè)定反應(yīng)速率 B.忽略錐形瓶?jī)?nèi)溶液體積的變化,用H+來(lái)表示10 s內(nèi)該反應(yīng)的速率為0.01 mol?L-1?s-1 C.忽略錐形瓶?jī)?nèi)溶液體積的變化,用Zn2+來(lái)表示10 s內(nèi)該反應(yīng)速率為0.01 mol?L-1?s-1 D.用H2來(lái)表示10 s內(nèi)該反應(yīng)的速率為0.000 2 mol?s-1 組卷:237引用:5難度:0.7 -
6.下列說(shuō)法中正確的是( )
A.已知t1℃時(shí),反應(yīng)C(s)+CO2(g)?2CO(g)△H>0的反應(yīng)速率為v,若升高溫度,逆反應(yīng)速率減小 B.恒壓容器中發(fā)生反應(yīng)N2+O2?2NO,若在容器中充入He,正、逆反應(yīng)的速率均不變 C.當(dāng)一定量的鋅粉和過量的6mol?L-1鹽酸反應(yīng)時(shí),為了減慢反應(yīng)速率,又不影響產(chǎn)生H2的總量,可向反應(yīng)器中加入一些水、CH3COONa溶液或NaNO3溶液 D.對(duì)任何一個(gè)化學(xué)反應(yīng),溫度發(fā)生變化,化學(xué)反應(yīng)速率一定發(fā)生變化 組卷:59引用:5難度:0.5 -
7.下列說(shuō)法正確的是( )
A.反應(yīng)物分子相互碰撞即能發(fā)生化學(xué)反應(yīng) B.活化分子之間的碰撞,一定可以發(fā)生化學(xué)反應(yīng) C.活化分子所具有的能量稱為活化能 D.活化分子百分?jǐn)?shù)越大,反應(yīng)速率越大 組卷:22引用:6難度:0.7 -
8.已知分解1mol H2O2放出熱量98kJ,在含少量I-的溶液中,H2O2分解的機(jī)理為:
H2O2+I-→H2O+IO- 慢 ①
H2O2+IO-→H2O+O2+I- 快 ②
下列有關(guān)該反應(yīng)的說(shuō)法中,正確的是( )A.I-是該反應(yīng)的催化劑,它可增加該反應(yīng)的活化分子百分?jǐn)?shù) B.當(dāng)反應(yīng)放出98 kJ的熱量時(shí),會(huì)生成1mol O2 C.反應(yīng)速率與I-的濃度無(wú)關(guān) D.2v(H2O2)=2v(H2O)═v(O2) 組卷:29引用:5難度:0.6
四、解答題
-
23.將等物質(zhì)的量的A和B,混合于2L的密閉容器中,發(fā)生如下反應(yīng) 3A(g)+B(g)═xC(g)+2D(g),經(jīng)過5min后測(cè)得D的濃度為0.5mol/L,c(A):c(B)=3:5,C的反應(yīng)速率是0.1mol/(L?min).
(1)x的值是;
(2)A在5min末的濃度是;
(3)B的平均反應(yīng)速率是,A的轉(zhuǎn)化率是.組卷:25引用:4難度:0.3 -
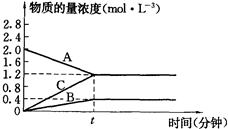 24.如圖表示800℃時(shí)A、B、C三種氣體物質(zhì)的濃度隨時(shí)間變化的情況,t是達(dá)到平衡狀態(tài)的時(shí)間,試回答:
24.如圖表示800℃時(shí)A、B、C三種氣體物質(zhì)的濃度隨時(shí)間變化的情況,t是達(dá)到平衡狀態(tài)的時(shí)間,試回答:
(1)該反應(yīng)的反應(yīng)物是;
(2)該反應(yīng)的化學(xué)反應(yīng)方程式是:;
(3)若到達(dá)平衡狀態(tài)的時(shí)間是2min,A物質(zhì)的平均反應(yīng)速率為.組卷:31引用:4難度:0.5


