2021-2022學(xué)年四川省廣安市鄰水縣石永中學(xué)高三(上)入學(xué)化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(42分)(每題只有一項符合題目要求,選對得6分,有錯選或多選不答得0分)
-
1.下列屬于強(qiáng)電解質(zhì)的是( )
A.硫酸鋇 B.食鹽水 C.二氧化硅 D.醋酸 組卷:535引用:15難度:0.8 -
2.下列關(guān)于Fe(OH)3膠體的說法正確的是( )
A.利用丁達(dá)爾效應(yīng)分離Fe(OH)3膠體和FeCl3溶液 B.Fe(OH)3膠體的膠粒帶負(fù)電荷,在通電的情況下膠粒向直流電源的正極移動,這種現(xiàn)象稱為電泳 C.向Fe(OH)3膠體中逐滴滴加稀硫酸,先出現(xiàn)沉淀,后沉淀溶解 D.向沸騰的NaOH稀溶液中邊滴加FeCl3飽和溶液,邊用玻璃棒攪動,然后繼續(xù)煮 組卷:118引用:2難度:0.7 -
3.設(shè)NA為阿伏加德羅常數(shù)的值,下列說法不正確的是( )
A.1 mol CH2=CH2分子中含有的共價鍵數(shù)為6NA B.500 mL 0.5 mol?L-1的NaCl溶液中微粒數(shù)大于0.5NA C.30 g HCHO與CH3COOH混合物中含C原子數(shù)為NA D.2.3 g Na與O2完全反應(yīng),反應(yīng)中轉(zhuǎn)移的電子數(shù)介于0.1NA和0.2NA之間 組卷:1011引用:4難度:0.7
二、非選擇題(58分)
-
10.已知化學(xué)反應(yīng)①:
Fe(s)+CO2(g)═FeO(s)+CO(g),其平衡常數(shù)為K1;化學(xué)反應(yīng)②:
Fe(s)+H2O(g)═FeO(s)+H2(g),其平衡常數(shù)為K2.在溫度
973K和1173K情況下,K1、K2的值分別如下:
(1)通過表格中的數(shù)值可以推斷:反應(yīng)①是溫度 K1 K2 973K 1.47 2.38 1173K 2.15 1.67 (填“吸熱”或“放熱”)反應(yīng)。
(2)現(xiàn)有反應(yīng)③:CO2(g)+H2(g)=CO(g)+H2O(g),請你寫出該反應(yīng)的平衡常數(shù)K3的數(shù)學(xué)表達(dá)式:K3=。
(3)根據(jù)反應(yīng)①與②可推導(dǎo)出K1、K2與K3之間的關(guān)系式。據(jù)此關(guān)系式及上表數(shù)據(jù),也能推斷出反應(yīng)③是(填“吸熱”或“放熱”)反應(yīng),要使反應(yīng)③在一定條件下建立的平衡向正反應(yīng)方向移動,可采取的措施有(填寫序號)。
A.縮小反應(yīng)容器容積 B.?dāng)U大反應(yīng)容器容積
C.降低溫度 D.升高溫度
E.使用合適的催化劑 F.設(shè)法減少CO的量
(4)圖甲、乙分別表示反應(yīng)③在t1時刻達(dá)到平衡、在t2時刻因改變某個條件而發(fā)生變化的情況:
①圖甲中t2時刻發(fā)生改變的條件是。
②圖乙中t2時刻發(fā)生改變的條件是。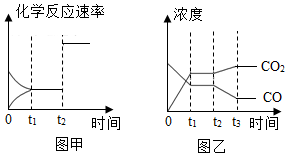 組卷:134引用:7難度:0.1
組卷:134引用:7難度:0.1 -
11.硫及其化合物有許多用途。相關(guān)物質(zhì)的物理常數(shù)如表所示:
回答下列問題:H2S S8 FeS2 SO2 SO3 H2SO4 熔點(diǎn)/℃ -85.5 115.2 >600(分解) -75.5 16.8 10.3 沸點(diǎn)/℃ -60.3 444.6 -10.0 45.0 337.0
(1)基態(tài)Fe原子價層電子的電子排布圖(軌道表達(dá)式)為,基態(tài)S原子電子占據(jù)最高能級的電子云輪廓圖為形。
(2)根據(jù)價層電子對互斥理論,H2S,SO2,SO3的氣態(tài)分子中,中心原子價層電子對數(shù)不同于其他分子的是。
(3)圖(a)為S8的結(jié)構(gòu),其熔點(diǎn)和沸點(diǎn)要比二氧化硫的熔點(diǎn)和沸點(diǎn)高很多,主要原因為。
(4)氣態(tài)三氧化硫以單分子形式存在,其分子的立體構(gòu)型為形,其中共價鍵的類型有種;固體三氧化硫中存在如圖(b)所示的三聚分子。該分子中S原子的雜化軌道類型為。
(5)FeS2晶體的晶胞如圖(c)所示,晶胞邊長為anm,FeS2相對式量為M、阿伏加德羅常數(shù)的值為NA,其晶體密度的計算表達(dá)式為g?cm-3;晶胞中Fe2+位于S22-所形成的八面體的體心,該正八面體的邊長為nm。組卷:1950引用:21難度:0.3


