滬教版高三(上)高考題單元試卷:第4章 電離理論(01)
發布:2024/4/20 14:35:0
一、選擇題(共28小題)
-
 1.水是生命之源,2014年我國科學家首次拍攝到水分子團簇的空間取向圖象,模型如圖所示,下列關于水的說法正確的是( )
1.水是生命之源,2014年我國科學家首次拍攝到水分子團簇的空間取向圖象,模型如圖所示,下列關于水的說法正確的是( )A.水是弱電解質 B.可燃冰是可以燃燒的水 C.氫氧兩種元素只能組成水 D.0℃時冰的密度比液態水的密度大 組卷:720引用:17難度:0.9 -
2.下列反應中,可用離子方程式H++OH-=H2O表示的是( )
A.NH4Cl+NaOH NaCl+NH3↑+H2O△B.Mg(OH)2+2HCl=MgCl2+2H2O C.NaOH+NaHCO3=Na2CO3+H2O D.NaOH+HNO3=NaNO3+H2O 組卷:679引用:32難度:0.9 -
3.現有等濃度的下列溶液:①醋酸,②苯酚,③苯酚鈉,④碳酸,⑤碳酸鈉,⑥碳酸氫鈉.按溶液pH由小到大排列正確的是( )
A.①④②③⑥⑤ B.④①②⑥⑤③ C.①④②⑥③⑤ D.④①②③⑥⑤ 組卷:621引用:21難度:0.9 -
4.離子方程式2Ca2++3
+3OH-→2CaCO3↓+HCO-3+3H2O可以表示( )CO2-3A.Ca(HCO3)2與NaOH溶液反應 B.NaHCO3與澄清石灰水反應 C.Ca(HCO3)2與澄清石灰水反應 D.NH4HCO3與澄清石灰水反應 組卷:3089引用:23難度:0.7 -
5.將0.1mol下列物質置于1L水中充分攪拌后,溶液中陰離子數最多的是( )
A.KCl B.Mg(OH)2 C.Na2CO3 D.MgSO4 組卷:677引用:42難度:0.9 -
6.25℃時,在10mL濃度均為0.1mol?L-1的NaOH和NH3?H2O混合溶液中滴加0.1mol?L-1鹽酸,下列有關溶液中粒子濃度關系正確的是( )
A.未加鹽酸時:c(OH-)>c(Na+)=c(NH3?H2O) B.加入10mL鹽酸時:c(NH4+)+c(H+)=c(OH-) C.加入鹽酸至溶液pH=7時:c(Cl-)=c(Na+) D.加入20mL鹽酸時:c(Cl-)=c(NH4+)+c(Na+) 組卷:3200引用:42難度:0.7 -
7.一定溫度下,水溶液中H+和OH-的濃度變化曲線如圖,下列說法正確的是( )

A.升高溫度,可能引起由c向b的變化 B.該溫度下,水的離子積常數為1.0×10-13 C.該溫度下,加入FeCl3可能引起由b向a的變化 D.該溫度下,稀釋溶液可能引起由c向d的變化 組卷:3563引用:65難度:0.9 -
8.下列指定反應的離子方程式正確的是( )
A.Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O B.(NH4)2Fe(SO4)2溶液與過量NaOH溶液反應制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ C.用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ D.向NaAlO2溶液中通入過量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- 組卷:2486引用:51難度:0.9 -
9.能正確表示下列反應的離子方程式是( )
A.濃鹽酸與鐵屑反應:2Fe+6H+═2Fe3++3H2↑ B.鈉與CuSO4溶液反應:2Na+Cu2+═Cu↓+2Na+ C.NaHCO3溶液與稀H2SO4反應: +2H+═H2O+CO2↑CO2-3D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ 組卷:5636引用:63難度:0.9 -
10.能正確表示下列反應的離子方程式是( )
A.用過量氨水吸收工業尾氣中的SO2:2NH3?H20+SO2═2NH4++SO32-+H2O B.氯化鈉固體與濃硫酸混合加熱:H2SO4+2Cl- SO2↑+Cl2↑+H2O△C.磁性氧化鐵溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O D.明礬溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ 組卷:3331引用:29難度:0.5
二、解答題(共2小題)
-
29.氨是合成硝酸、銨鹽和氮肥的基本原料,回答下列問題:
(1)氨的水溶液顯弱堿性,其原因為(用離子方程表示):0.1mol?L-1的氨水中加入少量NH4Cl固體,溶液的pH(填“升高”或“降低”);若加入少量明礬,溶液中的濃度NH+4(填“增大”或“減小”).
(2)硝酸銨加熱分解可得到N2O和H2O.250℃時,硝酸銨在密閉容器中分解達到平衡,該分解反應的化學方程式為,平衡常數表達式為;若有1mol硝酸銨完全分解,轉移的電子數為mol.
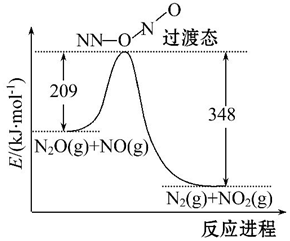
(3)由N2O和NO反應生成N2和NO2的能量變化如圖所示,若生成1molN2,其ΔH=kJ?mol-1.組卷:1032引用:16難度:0.7 -
30.(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,請寫出發生反應的離子方程式:
.
(2)在以上中性溶液中,繼續滴加Ba(OH)2溶液,請寫出此步反應的離子方程式:.組卷:377引用:22難度:0.5


