2013-2014學年上海市松江二中高二(上)開學化學試卷
發布:2024/10/28 17:30:3
一、選擇題(共25小題,每小題2分,滿分50分)
-
1.用FeS跟酸反應制取H2S氣體,最好使用的酸是( )
A.濃鹽酸 B.稀硫酸 C.濃硫酸 D.稀硝酸 組卷:18引用:1難度:0.9 -
2.0.1mol某單質與足量硫充分反應,質量增加了1.6g,則組成這種單質的元素不可能是( )
A.Ag B.Fe C.Cu D.K 組卷:34引用:1難度:0.9 -
3.下列說法正確的是( )
A.將4.0 g氫氧化鈉溶于200 mL水中,得到溶液的物質的量濃度是0.5 mol/L B.將11.2 L氯化氫氣體溶于水配成1 L溶液,所得溶液的物質的量濃度為0.5 mol/L C.從1 L 0.5 mol/L的鹽酸中取出10 mL,取出的鹽酸的物質的量濃度是0.005mol/L D.將40 g氫氧化鈉溶于水配成2 L溶液,此溶液的物質的量濃度為0.5 mol/L 組卷:18引用:1難度:0.9 -
4.常溫下,下列溶液中堿性最強的是( )
A.4 g氫氧化鈉溶于水配制成1 L溶液 B.0.05 mol/L的Ba(OH)2溶液 C.c(H+)=10-14 mol/L的溶液 D.同物質的量濃度的鹽酸和氫氧化鉀等體積混合后的溶液 組卷:18引用:1難度:0.9 -
5.濃硫酸、新制氯水、濃鹽酸分別滴在藍色石蕊試紙上,最終試紙的顏色分別是( )
A.黑色、紅色、紅色 B.紅色、紅色、紅色 C.黑色、白色、紅色 D.紅色、白色、黑色 組卷:15引用:1難度:0.9 -
6.m g銅和足量的濃硫酸反應,生成V升的SO2,則被還原的硫酸的物質的量是( )
A. molm64B. molm32C. molV11.2D. molV22.4組卷:5引用:1難度:0.9 -
7.能把Na2SO4、NH4NO3、(NH4)2SO4、KOH四瓶無色溶液加以區別(必要時可以加熱)的一種試劑是( )
A.BaCl2溶液 B.NaOH溶液 C.AgNO3溶液 D.Ba(OH)2溶液 組卷:10引用:1難度:0.9 -
8.某化學反應經過2min,生成物Y的濃度從0增加到0.24mol/L,而反應物X的濃度從0.3mol/L變成0.22mol/L.該反應可能是( )
A.X+2Z→3Y B.X+Z→2Y C.3X→Y+Z D.X→Y+3Z 組卷:9引用:1難度:0.9 -
9.在反應C(s)+CO2(g)=2CO(g)中,能使反應速率加快的是:( )
①增大壓強 ②升高溫度 ③將C粉碎 ④通CO2氣體 ⑤加入足量木炭粉.A.①②③ B.①②④ C.①②③④ D.全部 組卷:51引用:9難度:0.9 -
10.在一定的溫度下,可逆反應A(g)+3B(g)
 2C(g) 達到平衡的標志是( )
2C(g) 達到平衡的標志是( )A.單位時間生成nmolA,同時生成nmolC B.A、B、C的分子數之比為1:3:2 C.單位時間生成nmolA,同時生成3nmolB D.A、B、C的濃度不再變化 組卷:21引用:2難度:0.7 -
11.下列各種情況,不能用勒沙特列原理解釋的是( )
A.將裝有NO2和N2O4的混合物體的密閉容器浸入熱水中,容器中氣體顏色加深 B.將裝有Na2S2O3溶液與稀硫酸混合液的容器浸入熱水中,溶液迅速出現渾濁 C.在醋酸溶液中,加入一些醋酸鈉固體,溶液的pH增大 D.在氨水中加入濃氫氧化鈉溶液,有氨氣逸出 組卷:13引用:1難度:0.7
三、解答題(共2小題,滿分10分)
-
32.一種氮肥由硝酸銨和硫酸銨混合而成,取2.12g這種氮肥溶于水,加入足量的燒堿溶液,加熱至氣體全部放出,生成的氨氣為672mL(標準狀況下).求這種氮肥的含氮百分率.(要求寫出計算步驟)
.組卷:9引用:1難度:0.5 -
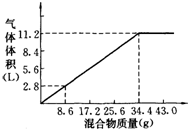 33.在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固體混合物,加熱充分反應,如圖表示加入的混合物質量與產生的氣體體積(標準狀況)的關系,試計算:
33.在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固體混合物,加熱充分反應,如圖表示加入的混合物質量與產生的氣體體積(標準狀況)的關系,試計算:
(1)NaOH的物質的量濃度;
(2)當NaOH溶液的體積為140mL,固體混合物的質量是51.6g時,充分反應后,生成氣體的體積(標準狀況)為L.
(3)當NaOH溶液的體積為180mL,固體混合物的質量仍為51.6g時,充分反應后,生成氣體的體積(標準狀況)為L.組卷:58引用:10難度:0.3


