2021-2022學年廣東省廣州市三校高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本大題20小題(1~10題每小題2分,11~20題每小題2分,共50分)
-
1.下列說法中正確的是( )
①酸性氧化物在一定條件下均能與堿發生反應
②金屬氧化物不一定都是堿性氧化物,但堿性氧化物一定都是金屬氧化物
③蔗糖、硫酸鋇和水分別屬于非電解質、強電解質和弱電解質
④硫酸、純堿、醋酸鈉和生石灰分別屬于酸、堿、鹽和氧化物
⑤因為膠粒比溶液中溶質粒子大,所以膠體可以用過濾的方法把膠粒分離出來
⑥氫氧化鐵膠體穩定存在的主要原因是膠粒直徑介于1nm到100nm之間A.6個 B.5個 C.4個 D.3個 組卷:140引用:11難度:0.8 -
2.下列物質屬于電解質的是( )
A.鹽酸 B.液氯 C.蔗糖 D.NaCl晶體 組卷:14引用:2難度:0.7 -
3.設NA為阿伏加德羅常數的值,下列說法不正確的是( )
A.78gNa2O2晶體所含陰陽離子的總數為3NA B.過氧化鈉與水反應時,生成0.1mol氧氣轉移的電子數為0.2NA C.常溫常壓下,14g由N2與CO組成的混合物氣體含有的原子數目為NA D.5.6g鐵在足量氧氣中燃燒失去0.3NA個電子 組卷:24引用:3難度:0.6 -
4.把一質量為2.3g的鈉用一鋁箔(上面用針刺有許多小孔)包好,放入到足量水中,理論上可收集到氫氣(標準狀況)( )
A.1.12L B.2.24L C.略小于1.12L D.略大于1.12L 組卷:81引用:3難度:0.7 -
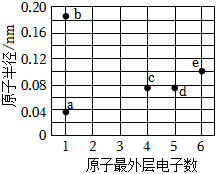 5.a、b、c、d、e均為短周期主族元素,其原子半徑和最外層電子數的關系如圖所示。下列說法正確的是( )
5.a、b、c、d、e均為短周期主族元素,其原子半徑和最外層電子數的關系如圖所示。下列說法正確的是( )A.單質的熔沸點:c<d B.元素的非金屬性:c<d<e C.a與b、e均形成共價化合物 D.d、e的最高價含氧酸均為強酸 組卷:67引用:7難度:0.5 -
6.常溫下,在酸性的透明溶液中,下列離子能大量共存的是( )
A.Na+、Fe3+、NO3-、SO42- B.Ca2+、Na+、ClO-、Cl- C.Ba2+、K+、HCO3-、NO3- D.K+、MnO4-、Cl-、SO42- 組卷:16引用:3難度:0.6 -
7.下列各組物質中,化學鍵類型完全相同的是( )
A.HI和NaI B.H2S和CO2 C.Cl2和He D.NaOH和NaBr 組卷:37引用:1難度:0.8 -
8.下列有關氯氣及氯水的說法正確的是( )
A.氫氣在氯氣中燃燒產生淡藍色火焰,在瓶口出現白煙 B.為了準確地了解氯水的酸性,可以用pH試紙準確測定其pH C.氯氣、次氯酸、次氯酸鹽均具有漂白性,可以用于漂白各種產品 D.Cl2與過量的Fe反應生成FeCl3 組卷:39引用:2難度:0.7
二、解答題(共4小題,滿分48分)
-
23.某小組利用高錳酸鉀與8mol/L鹽酸反應制氯氣并進行氯氣性質的探究,實驗裝置如圖1所示:
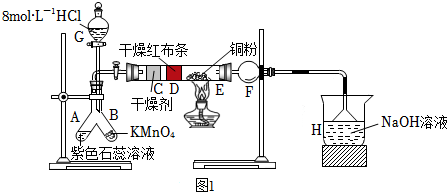
請回答下列問題:
(1)裝置F的名稱是。
(2)B中制取Cl2的化學反應方程式為。
(3)根據相關實驗現象就可以證明起漂白作用的不是氯氣而是次氯酸,相關現象是。
(4)H處裝置的作用是。
(5)實驗室需要用12mol/L的濃鹽酸來配制90mL8mol/L的鹽酸,需該濃鹽酸的體積為mL。
①所用的儀器除量筒、燒杯、玻璃棒、膠頭滴管外,還需要的儀器是。
②對所配制的鹽酸進行測定,發現其濃度偏大。配制過程中,下列各項操作可能引起該誤差的原因為(填字母)。
A.用量筒量取濃鹽酸時,仰視刻度線
B.容量瓶用蒸餾水洗滌后未經干燥
C.將稀釋后的鹽酸立即轉入容量瓶后,并立即進行后面的實驗操作
D.轉移溶液時,不慎有少量溶液灑出
E.定容時,俯視容量瓶刻度線
F.顛倒搖勻后,發現液面低于刻度線,不作任何處置
G.加蒸餾水時不慎超過刻度線,用膠頭滴管小心地吸去超出部分,使凹液面底部與刻度線相切
(6)鹵素互化物是指不同鹵素原子之間以共價鍵結合形成的化合物,XX′型鹵素互化物與鹵素單質結構相似、性質相近。圖2是部分鹵素單質和XX′型鹵素互化物的沸點與其相對分子質量的關系圖。它們的沸點隨著相對分子質量的增大而升高,其原因是。試推測ICl的沸點所處的最小范圍。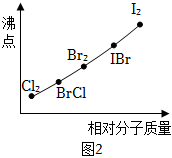 組卷:26引用:1難度:0.6
組卷:26引用:1難度:0.6 -
24.某磁鐵礦石A的主要成分是磁性氧化鐵(Fe3O4),還含少量的Al2O3、Cu2O。某工廠利用此礦石進行有關物質的回收利用,工藝流程如圖:(已知Cu2O不溶于水和堿,但溶于酸:Cu2O+2H+=Cu+Cu2++H2O)。根據流程(圖1)回答下列問題:
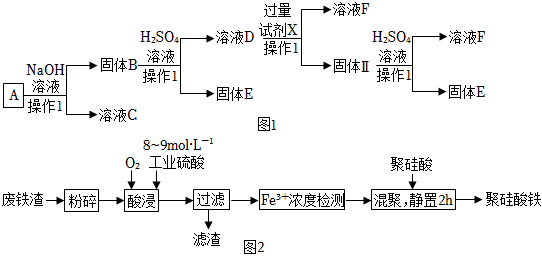
(1)溶液C的主要成分是。
(2)溶液D中的金屬陽離子與過量試劑X反應的離子方程式是。
(3)在溶液F中滴加NaOH溶液的現象是;發生的化學反應方程式為。
(4)聚硅酸鐵是目前無機高分子絮凝劑研究的熱點,一種用鋼管廠的廢鐵渣(主要成分Fe3O4,含少量碳及二氧化硅)為原料制備的流程如圖2:
①加熱條件下酸浸時,Fe3O4與硫酸反應。酸浸時,通入O2的目的是。
②“Fe3+濃度檢測”是先將100mL含Fe3+溶液用適量的SnSO4還原為Fe2+;再用酸性K2Cr2O7標準溶液測定Fe2+的量(Cr2O72-被還原為Cr3+),此時發生反應的離子方程式為:。若用掉0.2mol?L-1K2Cr2O7溶液50mL,則Fe3+的物質的量濃度為。組卷:41引用:3難度:0.6


