2021-2022學(xué)年廣西河池市高二(上)期末化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共16小題,每小題3分,共48分。在每小題列出的四個(gè)選項(xiàng)中,只有一項(xiàng)符合題目要求。
-
1.鹽類水解在生產(chǎn)生活中有著廣泛的作用,下列說(shuō)法中沒有用到鹽類水解的是( )
A.熱的純堿溶液去油污 B.利用泡沫滅火器滅火 C.配制FeCl2溶液時(shí),常加入少量鐵粉 D.FeCl3粉末溶于濃鹽酸配制FeCl3溶液 組卷:48引用:2難度:0.7 -
2.下列物質(zhì)中屬于強(qiáng)電解質(zhì),但在給定條件下不能導(dǎo)電的是( )
A.金屬銅 B.乙醇 C.液態(tài)氯化氫 D.醋酸 組卷:41引用:3難度:0.6 -
3.已知:H2(g)+F2(g)=2HF(g)ΔH=-270kJ?mol-1。下列說(shuō)法錯(cuò)誤的是( )
A.1molH2(g)與1molF2(g)反應(yīng)生成2mol液態(tài)HF放出的熱量大于270kJ B.在相同條件下,1molH2(g)與1molF2(g)的能量總和小于2mol HF(g)的能量 C.該反應(yīng)的逆反應(yīng)是吸熱反應(yīng) D.該反應(yīng)過程的能量變化可用如圖來(lái)表示 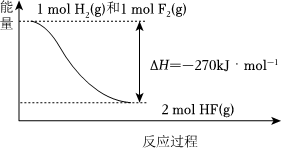 組卷:27引用:1難度:0.6
組卷:27引用:1難度:0.6 -
4.在四個(gè)不同的容器中,在不同的條件下進(jìn)行合成氨反應(yīng)N2(g)+3H2(g)?2NH3(g),根據(jù)下列在相同時(shí)間內(nèi)測(cè)得的結(jié)果判斷,生成氨的化學(xué)反應(yīng)速率最快的是( )
A.v(NH3)=0.012mol?L-1?s-1 B.v(H2)=0.3mol?L-1?min-1 C.v(N2)=0.2mol?L-1?min-1 D.v(H2)=0.6mol?L-1?min-1 組卷:27引用:2難度:0.5 -
5.下列化學(xué)用語(yǔ)表示不正確的是( )
A.醋酸的電離:CH3COOH?CH3COO-+H+ B.硝酸銨的水解:NH4++H2O?NH3?H2O+OH- C.硫酸氫鈉熔融時(shí)的電離:NaHSO4=Na++HSO4- D.碳酸鈣的溶解平衡:CaCO3(s)?Ca2+(aq)+CO32-(aq) 組卷:9引用:1難度:0.6 -
6.常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A.pH=2的溶液:Ba2+、Fe3+、Cl-、SO42- B.滴加酚酞變紅的溶液:SO42-、Mg2+、K+、NO3- C. =1×10-12的溶液:K+、Na+、CO32-、Cl-c(H+)c(OH-)D.有NO3-存在的溶液:NH4+、H+、Fe2+、Br- 組卷:10引用:1難度:0.7
二、非選擇題:本題共4大題,共52分。
-
19.醋酸是日常生活中最常見的調(diào)味劑和重要的化工原料,醋酸鉀是其常見的鹽。
請(qǐng)回答下列問題:
(1)0.2mol?L-1CH3COOK溶液中離子濃度由大到小的順序?yàn)?。
(2)物質(zhì)的量濃度均為0.2mol?L-1的CH3COOH和CH3COOK溶液等體積混合(混合前后忽略溶液體積變化),混合液中的下列關(guān)系式正確的是(填字母)。
A.c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
B.c(H+)+c(K+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.2mol?L-1
(3)常溫下0.1mol?L-1的CH3COOH溶液加水稀釋的過程,下列表達(dá)式的數(shù)值一定變大的是(填字母)。
A.c(H+)
B.c(H+)c(CH3COOH)
C.c(H+)?c(OH-)
D.c(OH-)c(H+)
(4)常溫時(shí),pH=3的醋酸溶液和pH=11的KOH溶液等體積混合后,溶液中c(K+)c(CH3COO-)(填“>”“<”或“=”,下同)。
(5)常溫時(shí),將mmol?L-1的醋酸溶液和nmol?L-1的KOH溶液等體積混合后,所得溶液的pH=7,則m與n的大小關(guān)系是mn。
(6)已知25℃時(shí),三種酸的電離平衡常數(shù)如下:
下列四種離子結(jié)合H+能力最強(qiáng)的是化學(xué)式 CH3COOH H2CO3 HClO Ka1 1.8×10-5 4.3×10-7 3.0×10-8 Ka2 - 5.6×10-11 - (填字母)。
A.HCO3-
B.CO32-
C.ClO-
D.CH3COO-
寫出HClO+Na2CO3(少量)反應(yīng)離子方程式:。組卷:47引用:3難度:0.6 -
20.I.液氧甲烷火箭發(fā)動(dòng)機(jī)是介于液氧煤油和液氧液氫之間的一個(gè)選擇,其燃燒的熱化學(xué)方程式為:CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3kJ?mol-1,根據(jù)以下信息,求算C=O的鍵能:
。
II.美國(guó)Bay工廠使用石油熱裂解的副產(chǎn)物甲烷來(lái)制取氫氣,其生產(chǎn)流程如圖所示:共價(jià)鍵 C-H O=O H-O 鍵能/(kJ?mol-1) 413 498 464 熱化學(xué)方程式 H2O(l)=H2O(g)ΔH=+44kJ?mol-1 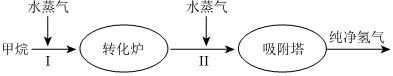
(1)該流程中第I步反應(yīng)為CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH>0。若圖表示在其他條件相同時(shí),分別測(cè)定不同壓強(qiáng)、不同溫度下CH4的平衡轉(zhuǎn)化率(縱坐標(biāo)為CH4的平衡轉(zhuǎn)化率),則p1p2(填“>”或“<”)。
(2)該流程的第II步反應(yīng)為CO(g)+H2O(g)?H2(g)+CO2(g),反應(yīng)的平衡常數(shù)隨溫度的變化如下表所示。
①?gòu)纳媳砜梢酝茢啵捍朔磻?yīng)的正反應(yīng)是溫度/℃ 400 500 830 1000 平衡常數(shù)K 10 9 1 0.6 (填“吸”或“放”)熱反應(yīng)。
②在500℃下,若開始時(shí)向恒容密閉容器中充入CO與H2O均為3mol,則達(dá)到平衡后CO的轉(zhuǎn)化率為。
③在830℃時(shí),以上表的物質(zhì)的量(單位為mol)投入恒容反應(yīng)器發(fā)生上述反應(yīng),其中反應(yīng)開始時(shí),向逆反應(yīng)方向進(jìn)行的有實(shí)驗(yàn)編號(hào) n(CO) n(H2O) n(H2) n(CO2) 甲 2 5 4 3 乙 3 3 2 2 丙 0.25 4 2 1 (填實(shí)驗(yàn)編號(hào))。
④在一個(gè)不傳熱的固定容積的容器中,判斷該反應(yīng)達(dá)到平衡的標(biāo)志是(填字母)。
A.各組分的物質(zhì)的量濃度不再改變;
B.v(CO2)正=v(H2O)逆;
C.混合氣體的密度不變;
D.混合氣體的平均相對(duì)分子質(zhì)量不變;
E.體系的壓強(qiáng)不再發(fā)生變化;
F.體系的溫度不再發(fā)生變化。
⑤如圖表示該反應(yīng)在t1時(shí)刻達(dá)到平衡,在t2時(shí)刻分別因改變某個(gè)條件而發(fā)生變化的情況:圖中t2時(shí)刻發(fā)生改變的條件可能是、(寫出兩種)。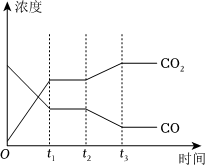 組卷:11引用:1難度:0.6
組卷:11引用:1難度:0.6


