2022-2023學年新疆和田地區民豐縣高二(上)期中化學試卷
發布:2024/8/28 1:0:8
一、單項選擇題:本題共10小題,每小題3分,共40分.每小題只有一個選項符合題意.
-
1.當前,廢電池必須進行集中處理的問題已被提到議事日程,其首要原因是( )
A.利用電池外殼的金屬材料 B.不使電池中滲泄的電解液腐蝕其他物品 C.回收其中石墨電極 D.防止電池中汞、鎘和鉛等重金屬離子對土壤和水源的污染 組卷:6引用:2難度:0.9 -
2.下列有關化學反應速率和限度的說法中不正確的是( )
A.實驗室用碳酸鈣和鹽酸反應制取CO2,相同質量的粉末狀碳酸鈣比塊狀反應要快 B.已知工業合成氨的正反應方向放熱,所以升溫正反應速率減小,逆反應速率增大 C.2SO2+O2?2SO3反應中,SO2的轉化率不能達到100% D.實驗室用H2O2分解制備O2,加入MnO2后,反應速率明顯加快 組卷:15引用:5難度:0.5 -
3.下列判斷及敘述,正確的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-801.3kJ/mol,則CH4的燃燒熱為801.3 kJ/mol B.C(s,石墨)+O2(g)=CO2(g)ΔH=-393.5kJ/mol,C(s,金剛石)+O2(g)=CO2(g)ΔH=-395kJ/mol,則石墨轉化為金剛石的過程中會放出熱量 C.稀鹽酸與稀氫氧化鈉溶液反應的中和熱為57.3kJ/mol,則稀硫酸與稀氫氧化鋇溶液反應生成1molH2O(l),放出熱量57.3kJ D.Sn(s,灰) Sn(s,白)ΔH=+2.1kJ/mol,則錫制品在寒冷的冬天易轉化為灰錫(粉末狀)而損壞>13.2℃<13.2℃組卷:1引用:1難度:0.5 -
4.N2(g)+3H2(g)
2NH3(g)△H<0.向容器中通入1mol N2和3mol H2,當反應達到平衡時,下列措施能提高N2轉化率的是( )催化劑高溫高壓
①降低溫度;②維持溫度、容積不變,按照物質的量之比為1:3再通入一定量的N2和H2;③增加N2的物質的量;④維持恒壓條件,通入一定量惰性氣體A.①④ B.①② C.②③ D.③④ 組卷:70引用:2難度:0.5 -
5.下列操作能實現相應目的的是( )
A.將FeCl3溶液加熱蒸干制備無水FeCl3 B.用干燥的pH試紙測定NaClO溶液的pH C.用飽和氯化銨溶液作焊接金屬時的除銹劑 D.用Cu作陰極,Fe作陽極,實現在Fe上鍍Cu 組卷:3引用:2難度:0.5
二、填空題:共計60分.
-
14.發射航天火箭常用肼(N2H4)與N2O4作燃料與助燃劑.
(1)肼易溶于水,性質與氨相似,用電離方程式表示肼的水溶液顯堿性的原因.
(2)肼(N2H4)與N2O4的反應為:2N2H4 (1)+N2O4 (1)=3N2(g)+4H2O(1)ΔH=-1225kJ?mol-1
已知反應相關的化學鍵鍵能數據如下:
則使1mol N2O4 (1)分子中化學鍵完全斷裂時需要吸收的能量是化學鍵 N-H N-N N≡N O-H E/(kJ?mol-1) 390 190 946 460
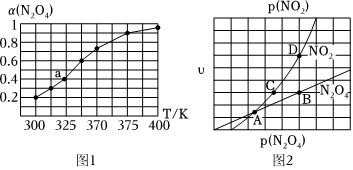
(3)N2O4與NO2之間存在反應N2O4(g)═2NO2(g).將一定量的N2O4放入恒容密閉容器中,測得其平衡轉化率[α(N2O4)]隨溫度變化如圖1所示.
①由圖推測該反應ΔH0(填“>”或“<”),理由為,若要提高N2O4的轉化率,除改變反應溫度外,其他措施有(要求寫出一條).
②圖中a點對應溫度下,已知N2O4的起始壓強p0為108kPa,列式計算該溫度下反應的平衡常數Kp=(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數).
③在一定條件下,該反應N2O4、NO2的消耗速率與自身壓強間存在關系:υ(N2O4)=k1p(N2O4),υ(NO2)=k2p2(NO2),其中kl、k2是與反應溫度有關的常數.相應的速率一壓強關系如圖2所示,一定溫度下,kl、k2與平衡常數Kp的關系是kl=,在圖標出的點中,能表示反應達到平衡狀態的點為,理由是.組卷:14引用:2難度:0.5 -
15.按要求回答下列問題:
Ⅰ.肼(N2H4)與氧化劑N2O4(l)反應生成N2和水蒸氣。已知:
①N2(g)+2O2(g)═N2O4(l) ΔH1=-195kJ?mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) ΔH2=-534kJ?mol-1
(1)寫出N2H4(l)和N2O4(l)完全反應生成N2和水蒸氣的熱化學方程式:。
Ⅱ.根據圖填空:
(2)圖1為含有少量Zn雜質的粗銀電解精煉銀的示意圖,則:
①(填“a”或“b“)極為含有雜質的粗銀。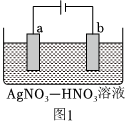
②電解一段時間后電解液中c(Ag+)濃度(填“偏大”、“偏小”或“不變”)。
③若b極有少量紅棕色氣體生成,則生成該氣體的電極反應式為。
(3)將鐵粉和活性炭的混合物用NaCl溶液濕潤后,置于如圖2所示裝置中,進行鐵的電化學腐蝕實驗。下列有關該實驗的說法正確的是。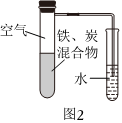
A.鐵被氧化的電極反應式為Fe-2e-═Fe2+
B.鐵腐蝕過程中化學能全部轉化為電能
C.活性炭的存在會加速鐵的腐蝕
D.以水代替NaCl溶液,鐵不能發生吸氧腐蝕組卷:0引用:2難度:0.6


