滬教版高三(上)高考題單元試卷:第1章 原子結構、元素周期表(01)
發布:2024/4/20 14:35:0
一、選擇題(共27小題)
-
1.613C-NMR(核磁共振)可以用于含碳化合物的結構分析.613C表示的碳原子( )
A.核外有13個電子,其中4個能參與成鍵 B.核內有6個質子,核外有7個電子 C.質量數為13,原子序數為6,核內有7個質子 D.質量數為13,原子序數為6,核內有7個中子 組卷:407引用:25難度:0.9 -
2.甲、乙是元素周期表中同一主族的兩種元素,若甲的原子序數為x,則乙的原子序數不可能是( )
A.x-2 B.x+4 C.x+8 D.x+18 組卷:225引用:105難度:0.9 -
3.已知元素X、Y的核電荷數分別是a和b,它們的離子Xm+和Yn-的核外電子排布相同,則下列關系式中正確的是( )
A.a=b+m+n B.a=b-m+n C.a=b+m-n D.a=b-m-n 組卷:796引用:62難度:0.9 -
4.一般情況下,前者無法決定后者的是( )
A.原子核外電子排布--元素在周期表中的位置 B.弱電解質的相對強弱--電離常數的大小 C.分子間作用力的大小--分子穩定性的高低 D.物質內部儲存的能量--化學反應的熱效應 組卷:310引用:14難度:0.7 -
5.不能作為判斷硫、氯兩種元素非金屬性強弱的依據是( )
A.單質氧化性的強弱 B.單質沸點的高低 C.單質與氫氣化合的難易 D.最高價氧化物對應的水化物酸性的強弱 組卷:1976引用:36難度:0.9 -
6.下列有關性質的比較,不能用元素周期律解釋的是( )
A.熱穩定性:Na2CO3>NaHCO3 B.非金屬性:Cl>Br C.堿性:NaOH>Mg(OH)2 D.酸性:H2SO4>H3PO4 組卷:226引用:118難度:0.7 -
7.下列離子中半徑最大的是( )
A.Na+ B.Mg2+ C.O2- D.F- 組卷:1972引用:53難度:0.9 -
8.原計劃實現全球衛星通訊需發射77顆衛星,這與銥(Ir)元素的原子核外電子數恰好相等,因此稱為“銥星計劃”.已知銥的一種同位素是
Ir,則其核內的中子數是( )19177A.77 B.114 C.191 D.268 組卷:335引用:31難度:0.9 -
9.短周期元素甲、乙、丙、丁的原子序數依次增大,甲和丁的原子核外均有兩個未成對電子,乙、丙、丁最高價氧化物對應的水化物兩兩之間能相互反應.下列說法錯誤的是( )
A.元素丙的單質可用于冶煉金屬 B.甲與丁形成的分子中有非極性分子 C.簡單離子半徑:丁>乙>丙 D.甲與乙形成的化合物均有氧化性 組卷:645引用:18難度:0.9 -
10.下列分子中所有原子都滿足最外層為8電子結構的是( )
A.SiCl4 B.H2O C.BF3 D.PCl5 組卷:94引用:87難度:0.9
二、解答題(共3小題)
-
29.元素單質及其化合物有廣泛用途,請根據周期表中第三周期元素相關知識回答下列問題:
(1)按原子序數遞增的順序(稀有氣體除外),下列說法正確的是
a.原子半徑和離子半徑均減小; b.金屬性減弱,非金屬性增強;
c.氧化物對應的水化物堿性減弱,酸性增強; d.單質的熔點降低.
(2)原子最外層電子數與次外層電子數相同的元素名稱為,氧化性最弱的簡單陽離子是
(3)已知:
工業制鎂時,電解MgCl2而不電解MgO的原因是化合物 MgO Al2O3 MgCl2 AlCl3 類型 離子化合物 離子化合物 離子化合物 共價化合物 熔點/℃ 2800 2050 714 191
制鋁時,電解Al2O3而不電解AlCl3的原因是
(4)晶體硅(熔點1410℃)是良好的半導體材料,由粗硅制純硅過程如下:
Si(粗)SiCl4Cl2460℃SiCl4(純)蒸餾Si(純)H21100℃
寫出SiCl4的電子式:.在上述由SiCl4制純硅的反應中,測得每生成1.12kg純硅需吸收a kJ熱量,寫出該反應的熱化學方程式:
(5)P2O5是非氧化性干燥劑,下列氣體不能用濃硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于實驗室制O2,若不加催化劑,400℃時分解只生成兩種鹽,其中一種是無氧酸鹽,另一種鹽的陰陽離子個數比為1:1,寫出該反應的化學方程式:.組卷:1859引用:29難度:0.5 -
30.鹵族元素包括F、Cl、Br等.
(1)下面曲線表示鹵族元素某種性質隨核電荷數的變化趨勢,正確的是.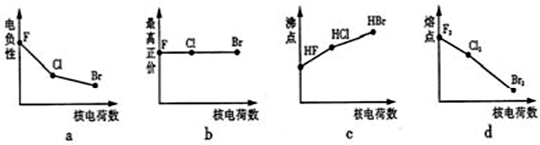
(2)利用“鹵化硼法”可合成含B和N兩種元素的功能陶瓷,如圖為其晶胞結構示意圖,則每個晶胞中含有B原子的個數為,該功能陶瓷的化學式為.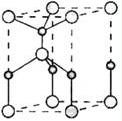
(3)BCl3和NCl3中心原子的雜化方式分別為和.第一電離能介于B、N之間的第二周期元素有種.
(4)若BCl3與XYn通過B原子與X原子間的配位鍵結合形成配合物,則該配合物中提供孤對電子的原子是.組卷:434引用:14難度:0.5


