2020-2021學(xué)年江蘇省蘇州中學(xué)高二(上)開學(xué)化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、單項選擇題:共11小題,每小題3分,共39分。每小題只有一個選項最符合題意。
-
1.化學(xué)是材料科學(xué)的基礎(chǔ)。下列有關(guān)材料的說法正確的是( )
A.華為手機使用的麒麟980芯片與光導(dǎo)纖維均屬于半導(dǎo)體材料 B.“天宮一號”使用的碳纖維,是一種新型的有機高分子材料 C.國產(chǎn)飛機C919用的氮化硅陶瓷,是新型的無機非金屬材料 D.制造“N95型口罩”使用的聚丙烯是一種天然高分子化合物 組卷:8引用:1難度:0.7 -
2.“中國芯”的主要原材料是高純單晶硅,反應(yīng)SiCl4(g)+2H2(g)
Si(S)+4HCl(g)可用于純硅的制備。下列有關(guān)說法正確的是( )高溫A.SiCl4為極性分子 B.HCl的電子式為 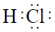
C.單晶硅為分子晶體 D.Si原子的結(jié)構(gòu)示意圖為 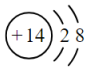 組卷:99引用:7難度:0.6
組卷:99引用:7難度:0.6 -
3.氧化物在生產(chǎn)、生活中有廣泛應(yīng)用。下列氧化物的性質(zhì)與用途具有對應(yīng)關(guān)系的是( )
A.Al2O3有兩性,可用于制造耐高溫陶瓷 B.ClO2有氧化性,可用于自來水消毒 C.SiO2硬度大,可用于制備光導(dǎo)纖維 D.SO2有還原性,可用于漂白有色織物 組卷:45引用:3難度:0.6 -
4.閱讀下列資料,完成4~6題。
硝酸是重要的化工原料,也是化學(xué)實驗室必備的重要試劑。工業(yè)上制取濃硝酸涉及下列反應(yīng):
①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(1)
③2N2O4(1)+O2(g)+2H2O(1)?4HNO3(aq)
下列說法正確的是( )A.NO能與水反應(yīng)生成硝酸 B.NO3-的空間構(gòu)型為平面三角形 C.N2O4制取HNO3是利用了N2O4的氧化性 D.常溫下可用鋁制容器盛裝稀硝酸 組卷:3引用:0難度:0.50 -
5.閱讀下列資料,完成4~6題。
硝酸是重要的化工原料,也是化學(xué)實驗室必備的重要試劑。工業(yè)上制取濃硝酸涉及下列反應(yīng):
①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(1)
③2N2O4(1)+O2(g)+2H2O(1)?4HNO3(aq)
已知2NO2+2OH-═NO3-+NO2-+H2O。下列裝置不能達到相應(yīng)實驗?zāi)康牡氖牵ā 。?/h2>A. 
生成NO2B. 
收集NO2C. 
吸收NO2尾氣D. 
使NO2充分轉(zhuǎn)化為HNO3組卷:9引用:0難度:0.50
二、解答題
-
16.BaS是一種重要的無機合成中間體,可以通過重晶石(主要成分BaSO4,還含有SiO2等雜質(zhì))制備得到。工業(yè)常以軟錳礦(主要成分MnO2)和BaS為原料制備碳酸錳。
(1)制取BaS溶液
將重晶石與活性炭混合均勻,高溫煅燒,冷卻后得重晶石熟料。向重晶石熟料中加入熱水,充分攪拌后過濾,得BaS溶液。
①測定SiO2是晶態(tài)還是非晶態(tài),可靠的科學(xué)方法是。
②已知:室溫下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。測得0.1mol?L-1BaS溶液pH≈13。溶液中OH-、S2-、HS-三種離子濃度由大到小的順序依次是。
③通過下列實驗方法測定重晶石熟料中BaS的質(zhì)量分數(shù):
步驟Ⅰ:準確稱取10.00g試樣,加適量水,待可溶物全部溶解,過濾,并洗滌沉淀,將洗滌液與濾液一并轉(zhuǎn)移至500mL容量瓶中,定容、搖勻。
步驟Ⅱ:取20.00mL醋酸溶液(過量)于錐形瓶中,再加入20.00mL 0.08000mol?L-1碘標準溶液,然后再向錐形瓶中加入10.00mL步驟Ⅰ所配的試樣溶液,邊加邊振蕩。充分反應(yīng)后,硫元素完全轉(zhuǎn)化為硫單質(zhì)。
步驟Ⅲ:以淀粉為指示劑,用0.05000mol?L-1Na2S2O3標準溶液滴定至終點,發(fā)生反應(yīng):I2+2S2═2I-+S4O2-3,消耗Na2S2O3溶液20.00mL。計算試樣中BaS的質(zhì)量分數(shù)寫出計算過程O2-6。
(2)制取高純碳酸錳
BaS溶液和軟錳礦經(jīng)反應(yīng)、過濾、酸溶、凈化可制得的MnSO4溶液。
①MnSO4溶液和NH4HCO3固體混合后,極速反應(yīng)生成MnCO3。反應(yīng)方程式為2+Mn2+═MnCO3↓+H2O+CO2↑。HCO-3
實際制取MnCO3時,一般選擇使用氨水—NH4HCO3混合溶液代替NH4HCO3固體,這樣改進的優(yōu)點是。
②已知:6.5<pH<7.5時,碳酸錳產(chǎn)率較高。pH=8.1時,Mn+開始形成Mn(OH)2沉淀。請設(shè)計以MnSO4溶液、氨水—NH4HCO3混合溶液為原料制備高純碳酸錳的實驗方案:。(實驗中須使用的試劑有:稀鹽酸、BaCl2溶液、蒸餾水)組卷:34引用:3難度:0.6 -
17.燃煤煙氣中的NOx、SO2經(jīng)處理后可被吸收。
(1)若煙氣主要成分為NO、SO2,可通過電解法除去,其原理如圖1所示。陰極的電極反應(yīng)式為。電解過程得到產(chǎn)物為。
(2)若煙氣主要成分為NO2、SO2,可通入NaOH溶液將NO2完全轉(zhuǎn)化為。則NO2、SO2與NaOH反應(yīng)的離子方程式為NO-2。
(3)O3氧化性強于O2,能更有效地氧化NO。
①2NO(g)+O2(g)═2NO2(g)ΔH1=-114kJ?mol-1
2O3(g)═3O2(g)ΔH2=-284.2kJ?mol-1(活化能Ea=119.2kJ?mol-1)
NO(g)+O3(g)═NO2(g)+O2(g)ΔH3=kJ?mol-1(活化能Ea=3.2kJ?mol-1)
②NO可經(jīng)O3處理后再用堿液吸收而實現(xiàn)脫除。為分析氧化時溫度對NO脫除率的影響,將NO與O3混合反應(yīng)一段時間,再用堿液吸收氧化后的氣體。其他條件相同時,NO脫除率隨NO與O3混合反應(yīng)時溫度變化如圖2所示。溫度在50~150℃時,隨著溫度升高,NO脫除率無明顯變化;溫度超過150℃時,隨著溫度升高,NO脫除率下降。其可能原因是。
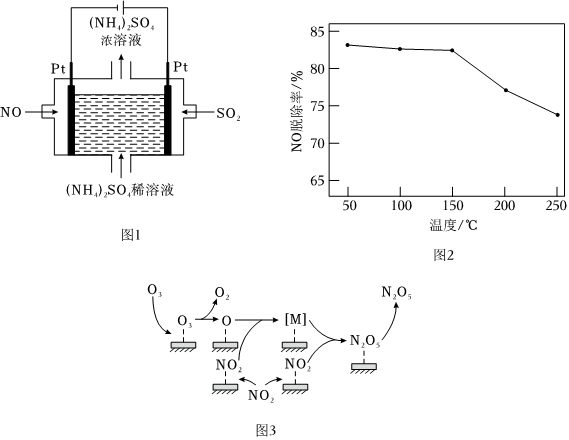
(4)用O3氧化NO2時,使用催化劑可提高氧化效率。研究發(fā)現(xiàn)NO2在某催化劑表面被O3氧化時反應(yīng)機理如圖3所示,反應(yīng)過程中,氮氧化物[M]與NO2按物質(zhì)的量1:1反應(yīng)生成N2O5,[M]的化學(xué)式為。該催化氧化過程總反應(yīng)的化學(xué)方程式為。組卷:56引用:5難度:0.5


