2021-2022學年廣東省茂名市高州一中高二(上)期末化學試卷
發布:2024/10/27 1:30:2
一、選擇題:本題共16小題,共44分。第1~10題,每小題2分;第11~16題,每小題2分。在每小題給出的四個選項中,只有一項是符合題目要求的.
-
 1.煙花又稱花炮、焰火,漢族勞動人民發明較早,主要用于軍事、盛大的典禮或表演中。下列對形成煙花的過程敘述錯誤的是( )
1.煙花又稱花炮、焰火,漢族勞動人民發明較早,主要用于軍事、盛大的典禮或表演中。下列對形成煙花的過程敘述錯誤的是( )A.與電子的躍遷有關 B.該過程中吸收能量 C.焰色反應屬于物理變化 D.該過程中金屬原子可能由激發態轉化為基態 組卷:22引用:2難度:0.8 -
2.化學與社會、科學、技術、環境密切相關,下列說法錯誤的是( )
A.鐵表面鍍鋅可以增強鐵的抗腐蝕性 B.采用合適的催化劑可以提高合成氨工業中原料的轉化率 C.合理利用太陽能、風能和氫能等能源有利于實現“低碳經濟” D.鋼鐵在潮濕的空氣中容易生銹,其主要原因是形成了原電池 組卷:33引用:4難度:0.7 -
3.化學與生活密切相關,下列與鹽類水解無關的是( )
A. 
純堿去油污B. 
食醋除水垢C. 
明礬凈化水D. 
NH4Cl除鐵銹組卷:13引用:6難度:0.6 -
4.下列有關元素周期表及元素周期律的說法錯誤的是( )
A.N能層的能級數最多為3個 B.Cu元素在元素周期表的ds區 C.F元素在同周期中電負性最大 D.根據對角線規則,鈹和鋁的化學性質具有相似性 組卷:50引用:5難度:0.7 -
5.下列屬于水解的離子方程式且書寫正確的是( )
A.HCO3-+H2O?H2O+CO32- B.CH3COO-+H2O?CH3COOH+OH- C.SO32-+2H2O?H2SO3+2OH- D.Fe3++3H2O?Fe(OH)3↓+3H+ 組卷:42引用:5難度:0.9 -
6.室溫時,在由水電離產生的c(H+)和c(OH-)的乘積為1×10-20的溶液中,可能大量共存的離子組是( )
A.NH4+、Na+、Cl-、SO42- B.Na+、K+、Fe3+、I- C.Na+、Al3+、Cl-、ClO- D.Na+、K+、Cl-、HCO3- 組卷:19引用:3難度:0.7
二、非選擇題:本題共4小題,共56分。
-
 19.某小組為研究電化學原理,設計如圖所示裝置。
19.某小組為研究電化學原理,設計如圖所示裝置。
(1)若a和b不相連,c是銅片,d是鋅片,m是稀硫酸,則鋅片上的現象是,此時能量轉化的主要形式是化學能轉化為能。
(2)若a和b用導線相連:
①c是石墨電極,d是銅片,m是硝酸銀溶液,電池總反應的離子方程式為。
②c、d均是Pt電極,m是稀硫酸,分別向兩極通入甲烷和氧氣,通入甲烷一極的電極反應式是。
(3)若a和b分別連接直流電源的兩電極:
①利用該裝置實現粗銅的精煉,粗銅應作(填“極”或“陽 極”)。
②c、d是石墨電極,m是NaCl溶液,向溶液中滴加幾滴酚酞試液。實驗開始后c極周圍溶液首先出現紅色,則b連接直流電源的(填“正極”或“負 極”),通電時總反應的離子方程式是,檢驗d極氣體產物的方法是。
③c、d分別是石墨電極和銅電極,m是NaOH依溶液,通過反應:2Cu+H2OCu2O+H2↑可制得納米級Cu2O.陽極的電極反應式是電解。組卷:9引用:2難度:0.6 -
20.過氧化鈣常用作殺菌劑及封閉膠泥的快干劑,難溶于水,溶于酸生成過氧化氫。以大理石(含有少量氧化亞鐵和氧化鐵雜質)為原料制備過氧化鈣的工藝流程如圖所示。
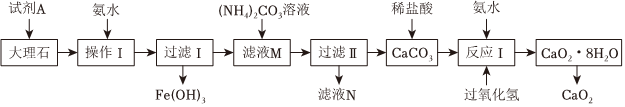
回答下列問題:
(1)操作Ⅰ的目的是調節溶液的pH,使鐵元素完全沉淀,則試劑A最好選用(填標號)
a.鹽酸
b.硝酸
c.鹽酸和過氧化氫
d.硫酸
(2)測得濾液M中Ca2+的物質的量濃度為0.56mol?L-1,若加入等體積的(NH4)2CO3溶液時CaCO3開始沉淀,則(NH4)2CO3的物質的量濃度為【已知Ksp(CaCO3)=2.8×10-9】。
(3)反應Ⅰ是放熱反應。不同濃度的H2O2溶液對反應生成CaO2產率的影響如下表:
分析題給信息,解釋H2O2的濃度大于20%后CaO2產率反而減小的原因:H2O2的濃度/% 5 10 15 20 25 30 CaO2的產率/% 62.40 63.10 63.20 64.54 62.42 60.40 。
(4)制備所得的過氧化鈣中常含有CaO雜質,實驗室可按以下步驟測定CaO2的質量分數:
步驟1:準確稱取0.3900g過氧化鈣樣品,置于250mL的錐形瓶中;
步驟2:加入10mL蒸餾水和20mL磷酸,振蕩使樣品完全溶解;
步驟3:用0.1000mol?L-1的酸性KMnO4溶液滴定至終點,記錄數據;
步驟4:平行測定3次(數據記錄見下表),計算試樣中CaO2的質量分數
已知:上述實驗過程中反應關系為CaO2~H2O2,5H2O2~2KMnO4。實驗 1 2 3 V(酸性KMnO4溶液)/mL 19.50 19.48 19.52
①步驟3判斷滴定達到終點的現象是。
②由表中數據可知,該樣品中CaO2的質量分數為%。若實驗時剛洗凈的滴定管未用酸性KMnO4溶液潤洗,則測定的CaO2的質量分數會(填“偏高”“偏低”或“無影響”)。組卷:35引用:3難度:0.5


