2021-2022學(xué)年湖南省長(zhǎng)沙市雅禮中學(xué)高二(下)入學(xué)化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共18小題,每小題3分,總共54分;在每小題給出的四個(gè)選項(xiàng)中,其中只有一項(xiàng)符合要求。
-
1.中華文化源遠(yuǎn)流長(zhǎng)、博大精深。從化學(xué)的視角看,下列理解中不正確的是( )
A B C D 千淘萬(wàn)漉雖辛苦,吹盡黃沙始到金。劉禹錫《浪淘沙》詩(shī)句 
司母戊鼎

侯德榜
瓷器(China)詩(shī)句中“淘”、“漉”相當(dāng)于分離提純操作中的“過濾”。 屬青銅制品,是我國(guó)古代科技光輝成就的代表之一。 我國(guó)化學(xué)工業(yè)的奠基人,主要成就為侯氏制堿法,該堿指的是燒堿。 屬硅酸鹽產(chǎn)品,China一詞又指“瓷器”,這反映了在西方人眼中中國(guó)作為“瓷器故鄉(xiāng)”的形象。 A.A B.B C.C D.D 組卷:1引用:1難度:0.6 -
2.南京理工大學(xué)團(tuán)隊(duì)成功合成了能夠在室溫下穩(wěn)定存在的五氮陰離子鹽(N5)6(H2O)3(NH4)4Cl,這五氮陰離子N5-是制備全氮類物質(zhì)的重要中間體,則下列有關(guān)的說法正確的是( )
A.每個(gè)N5+含有34個(gè)電子 B.N5+N5-屬于典型的離子化合物 C.(N5)6(H2O)3(NH4)4Cl中含有三種離子 D.N5+N5-中既含極性共價(jià)鍵又含非極性共價(jià)鍵 組卷:24引用:2難度:0.7 -
3.下列有關(guān)的推論正確的是( )
A.S(g)+O2(g)=SO2(g)ΔH1,S(s)+O2=SO2(g)ΔH2,則ΔH1<ΔH2 B.C(石墨,s)=C(金剛石,s)ΔH=+1.9kJ?mol-1,則金剛石比石墨穩(wěn)定 C.2C(s)+O2(g)=2CO(g)ΔH=-221kJ?mol-1,則碳的燃燒熱的數(shù)值小于110.5kJ?mol-1 D.OH-(aq)+H+(aq)=H2O(1)ΔH=-57.4kJ?mol-1,則含有40gNaOH的稀溶液與過量稀醋酸充分反應(yīng),最終放出的熱量為57.4kJ 組卷:2引用:2難度:0.7 -
4.下列指定反應(yīng)的離子方程式正確的是( )
A.硫化亞鐵與濃硝酸混合:2H++FeS=H2S↑+Fe2+ B.將少量SO2通入到氨水中:SO2+NH3?H2O=NH4++HSO3- C.碳酸氫鈉溶液與少量石灰水反應(yīng):HCO3-+Ca2++OH-=CaCO3↓+H2O D.KClO和KOH混合溶液與Fe(OH)3反應(yīng):3ClO-+2Fe(OH)3+4OH-=2FeO42-+3Cl-+5H2O 組卷:1引用:2難度:0.6 -
5.下列制取Cl2、探究其漂白性、收集并進(jìn)行尾氣處理的原理和裝置合理的是( )
A. 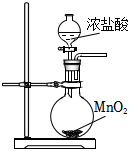
制取Cl2B. 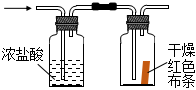
探究漂白性C. 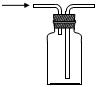
收集Cl2D. 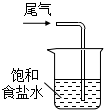
尾氣處理組卷:24引用:4難度:0.5 -
6.2020年8月初,黎巴嫩首都貝魯特港口發(fā)生大規(guī)模爆炸,該爆炸是由于儲(chǔ)存在倉(cāng)庫(kù)的2750噸硝酸銨引起的。已知爆炸時(shí)硝酸銨按下式分解:4NH4NO3═3N2↑+2NO2↑+8H2O,則該反應(yīng)中被氧化和被還原的N原子數(shù)目之比為( )
A.1:3 B.1:2 C.1:1 D.3:1 組卷:14引用:1難度:0.5 -
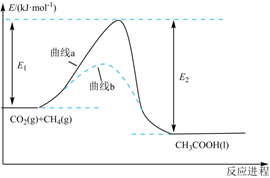 7.我國(guó)科學(xué)家提出了由CO2和CH4直接轉(zhuǎn)化為CH3COOH的催化反應(yīng)進(jìn)程,該進(jìn)程如圖所示。則下列說法錯(cuò)誤的是( )
7.我國(guó)科學(xué)家提出了由CO2和CH4直接轉(zhuǎn)化為CH3COOH的催化反應(yīng)進(jìn)程,該進(jìn)程如圖所示。則下列說法錯(cuò)誤的是( )A.該反應(yīng)是放熱反應(yīng) B.曲線a的活化能大于曲線b C.上述化學(xué)工藝符合綠色化學(xué)要求 D.按照曲線b發(fā)生上述轉(zhuǎn)化反應(yīng),其中CO2和CH4的轉(zhuǎn)化率相對(duì)高些 組卷:10引用:2難度:0.7
二、非選擇題:共4個(gè)大題,每空2分,總共46分。
-
22.為探究乙烯的性質(zhì),將乙烯持續(xù)地通入下列各試管中,有關(guān)裝置如圖所示。
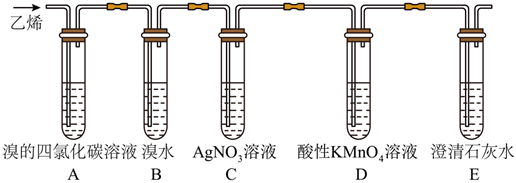
根據(jù)上述裝置,回答下列問題:
(1)寫出A裝置中發(fā)生的化學(xué)方程式。
(2)B裝置中的現(xiàn)象是;E裝置的作用是。
(3)丙烯(CH2=CHCH3)與乙烯具有相似的化學(xué)性質(zhì),則丙烯與溴水發(fā)生加成反應(yīng)所得的產(chǎn)物為(請(qǐng)用結(jié)構(gòu)簡(jiǎn)式回答)。
(4)從氧化還原角度分析將乙烯通入D中此時(shí)發(fā)生反應(yīng)乙烯表現(xiàn)出的性質(zhì)為;請(qǐng)寫出乙烯與酸性高錳酸鉀反應(yīng)的離子方程式。組卷:225引用:2難度:0.7 -
23.“綠水青山就是金山銀山”,近年來,綠色發(fā)展、生態(tài)保護(hù)成為中國(guó)展示給世界的一張新“名片”。汽車尾氣是造成大氣污染的重要原因之一,減少氮的氧化物在大氣中的排放是環(huán)境保護(hù)的重要內(nèi)容之一。回答下列問題:
(1)已知:N2(g)+O2(g)═2NO(g)ΔH1=+180.5kJ/mol
C(s)+O2(g)═CO2(g)ΔH2=-393.5kJ/mol
2C(s)+O2(g)═2CO(g)ΔH3=-221kJ/mol
若某反應(yīng)的平衡常數(shù)表達(dá)式為:K=,則此反應(yīng)的熱化學(xué)方程式[c(N2)c2(CO2)][c2(NO)c2(CO)]。
(2)N2O5在一定條件下可發(fā)生分解:2N2O5(g)?4NO2(g)+O2(g),某溫度下恒容密閉容器中加入一定量N2O5,測(cè)得N2O5濃度隨時(shí)間的變化如表:
①反應(yīng)開始時(shí)體系壓強(qiáng)為P0,第2min時(shí)體系壓強(qiáng)為P1,則P1:P0=t/min 0 1 2 3 4 5 c(N2O5)/mol?L-1 1.00 0.71 0.50 0.35 0.25 0.17 。
②一定溫度下,在恒容密閉容器中充入一定量N2O5進(jìn)行該反應(yīng),能判斷反應(yīng)已達(dá)到化學(xué)平衡狀態(tài)的是(填字母)。
a.NO2和O2的濃度比保持不變
b.容器中壓強(qiáng)不再變化
C.2v正(NO2)=v逆(N2O5)
d.氣體的密度保持不變
(3)KP是用反應(yīng)體系中氣體物質(zhì)的分壓來表示的平衡常數(shù),即將K表達(dá)式中平衡濃度用平衡分壓代替。已知反應(yīng):NO2(g)+CO(g)?NO(g)+CO2(g),該反應(yīng)中正反應(yīng)速率v正=k正?p(NO2)?p(CO),逆反應(yīng)速率v逆=k逆?p(NO)?p(CO2),其中k正、k逆為速率常數(shù),則Kp為(用k正、k逆表示)。
(4)如圖是密閉反應(yīng)器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下合成NH3反應(yīng)達(dá)到平衡時(shí),混合物中NH3的物質(zhì)的量分?jǐn)?shù)隨壓強(qiáng)的變化曲線,已知該反應(yīng)為放熱反應(yīng)。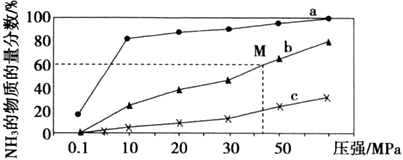
①曲線a對(duì)應(yīng)的溫度是。
②M點(diǎn)對(duì)應(yīng)的H2的轉(zhuǎn)化率是。組卷:10引用:1難度:0.6


