2016-2017學年河南省南陽市新野一中高二(下)第一次周考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題3分,共48分.)
-
1.下列各對物質中,互為同系物的是( )
A.CH3-CH=CH2與 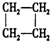
B. 
C.HCOOC2H5與CH3COOCH3 D. 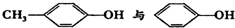 組卷:82引用:18難度:0.9
組卷:82引用:18難度:0.9 -
2.標準狀況下1.68L某可燃氣體在足量氧氣中完全燃燒,將產物通入足量澄清石灰水,得到白色沉淀質量15.0g,若用足量堿石灰吸收燃燒產物,質量增加9.3g,則該可燃氣體為( )
A.C2H4 B.C3H6 C.C2H2 D.C2H6 組卷:24引用:3難度:0.6 -
3.下列化學式能代表一種純凈物的是( )
A.C B.C4H10 C.C2H4Cl2 D.CH2Cl2 組卷:8引用:1難度:0.8 -
4.只用一種試劑就能將甲苯、己烯、四氯化碳、碘化鉀溶液區分開,該試劑可以是( )
A.高錳酸鉀溶液 B.溴化鉀溶液 C.溴水 D.硝酸銀溶液 組卷:76引用:10難度:0.7 -
5.下列說法錯誤的是( )
A.1個C3H8分子中的共價鍵總數為10 B.除去苯中含有的少量溴可以加入NaOH溶液,然后蒸餾出苯 C.可用溴的四氯化碳溶液除去丙烷中的丙烯 D.某聚乙烯單鏈分子的相對分子質量為519766,則該聚乙烯單鏈分子的聚合度為19991 組卷:5引用:2難度:0.7 -
6.某烯烴氫化后得到的飽和烴是
 ,則原烯烴可能有的結構簡式有( )
,則原烯烴可能有的結構簡式有( )A.1種 B.2種 C.3種 D.4種 組卷:387引用:46難度:0.9 -
7.0.5mol 氣態烴A 最多和1mol HCl加成,生成氯代烷B,1mol B與4mol Cl2 發生取代反應,生成只含碳、氯兩種元素的化合物C,則A的分子式為( )
A.C2H4 B.C2H2 C.C3H4 D.C4H6 組卷:6引用:5難度:0.7 -
8.設NA為阿伏加德羅常數的值,下列有關敘述不正確的是( )
A.標準狀況下,1L庚烷完全燃燒所生成的氣態產物的分子數為 NA722.4B.1 mol甲基(-CH3)所含的電子總數為9NA C.0.5 摩1,3-丁二烯分子中含有C=C雙鍵數為 NA D.1 mol碳正離子( )所含的電子總數為8NACH+3組卷:179引用:32難度:0.9
二、填空題
-
23.在一個2L的密閉容器中,投入反應物,發生反應2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的變化如圖所示:
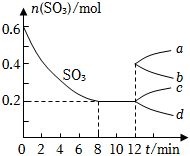
(1)寫出該反應的平衡常數表達式并根據8min時到達平衡計算出結果.
(2)用O2表示0到8min內該反應的平均速率v=.
(3)能說明該反應已達到平衡狀態的是.
A.v(SO3)=2v(O2) B.容器內壓強保持不變
C.v(SO2)逆=2v(O2)正 D.容器內密度保持不變
(4)在第12min時,容器壓縮到1L,則SO3的變化曲線為.
A.a B.b C.c D.d
(5)若保持容積不變在第12min時,加入SO3(g),則平衡向反應方向移動(填“正”或“逆”).SO3的體積分數(填“增大”或“減小”).組卷:25引用:4難度:0.5 -
24.二甲醚(CH3OCH3)是一種重要的清潔燃料氣,其儲運、燃燒安全性、理論燃燒溫度等性能指標均優于液化石油氣,也可用作燃燒電池,具有很好的發展前景.
(1)已知H2、CO和CH3OCH3的燃燒熱(ΔH)分別為-285.5kJ/mol、-283kJ/mol和-1460.0kJ/mol,則工業上利用水煤氣成分按1:1合成二甲醚的熱化學方程式為:.
(2)工業上采用電浮遠凝聚法處理污水時,保持污水的pH在5.0,通過電解生成Fe(OH)3膠體,吸附不溶性雜質,同時利用陰極產生的H2,將懸浮物帶到水面,利于除去.實驗室以二甲醚燃料電池模擬該方法設計的裝置如圖所示: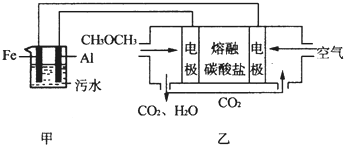
①乙裝置以熔融碳酸鹽為電解質,稀土金屬材料為電極.寫出該燃料電池的正極電極反應式;下列物質可用做電池熔融碳酸鹽的是.
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②寫出甲裝置中陽極產物離子生成Fe(OH)3沉淀的離子方程式.
③已知常溫下Ksp[Fe(OH)3]=4.0×10-38,電解一段時間后,甲裝置中c(Fe3+)=.
④已知:H2S的電離平衡常數:K1=9.1×10-8、K2=1.1×10-12;H2CO3的電離平衡常數:K1=4.31×10-7、K2=5.61×10-11.測得電極上轉移電子為0.24mol時,將乙裝置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列選項正確的是
A.發生反應的離子方程式為:CO2+S2-+H2O═CO32-+H2S
B.發生反應的離子方程式為:CO2+S2-+H2O═HCO3-+HS-
C.c(Na+)═2[c(H2S)+c(HS-)+c(S2-)]
D.c(Na+)+c(H+)═2c(CO32-)+2c(S2-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)組卷:7引用:2難度:0.5


