2023-2024學年北京十五中高三(上)開學化學試卷
發布:2024/8/11 1:0:1
一、本部分共14題,每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.下列裝置工作原理與氧化還原反應無關的是( )
A. B. C. D. 



太陽能集熱器 甲烷燃料電池 臭氧消毒柜 燃氣灶 A.A B.B C.C D.D 組卷:43引用:1難度:0.5 -
2.下列化學用語或圖示表達不正確的是( )
A.甲基的電子式: 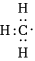
B.基態氮原子的軌道表示式: 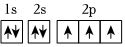
C.p-pσ鍵電子云輪廓圖: 
D.CO2分子的空間結構模型:  組卷:5引用:1難度:0.8
組卷:5引用:1難度:0.8 -
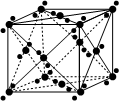 3.干冰(CO2)的晶胞結構如圖所示。下列說法不正確的是( )
3.干冰(CO2)的晶胞結構如圖所示。下列說法不正確的是( )A.干冰晶體屬于分子晶體 B.干冰晶胞中,含有4個CO2分子 C.干冰晶體中,每個CO2周圍等距且緊鄰的CO2有6個 D.干冰晶體中CO2分子間作用力較小,常壓下易升華 組卷:257引用:4難度:0.7 -
4.下列對于物質結構和性質的分析不正確的是( )
A.碳的原子半徑小于硅,使金剛石熔點高于晶體硅 B.鄰羥基苯甲醛形成了分子內氫鍵,其沸點高于對羥基苯甲醛 C.氟的電負性大于氯,導致三氟乙酸的酸性強于三氯乙酸 D.鹵代烴中C—X鍵極性較強,使鹵素原子易被取代 組卷:125引用:6難度:0.6 -
5.下列實驗中的顏色變化,與氧化還原反應無關的是( )
A B C D 實驗 NaOH溶液滴入FeSO4溶液中 石蕊溶液滴入氯水中 Na2S溶液滴入AgCl濁液中 熱銅絲插入稀硝酸中 現象 產生白色沉淀,隨后變為紅褐色 溶液變紅,隨后迅速褪色 沉淀由白色逐漸變為黑色 產生無色氣體,隨后變為紅棕色 A.A B.B C.C D.D 組卷:1509引用:24難度:0.9 -
6.下列方程式能準確解釋相應事實的是( )
A.硫酸型酸雨的形成:SO2+H2O?H2SO4 B.84消毒液不能與潔廁靈混用:ClO-+Cl-+2H+═Cl2↑+H2O C.和面時在小蘇打中加少量醋酸,增強效果:H++HCO3-═H2O+CO2↑ D.向NaHSO4溶液中加入足量Ba(OH)2溶液,得到白色沉淀:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O 組卷:42引用:5難度:0.7
二、本部分共5題,共58分。
-
18.用含鋰廢渣(主要金屬元素的含量:Li3.50%Ni6.55%Ca6.41%Mg13.24%)制備Li2CO3,并用其制備Li+電池的正極材料LiFePO4。部分工藝流程如圖:
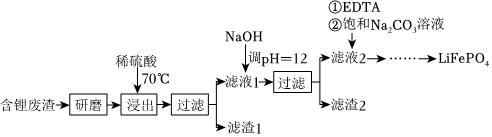
資料:ⅰ.濾液1、濾液2中部分離子的濃度(g?L-1):
ⅱ.EDTA能和某些二價金屬離子形成穩定的水溶性絡合物。Li+ Ni2+ Ca2+ Mg2+ 濾液1 22.72 20.68 0.36 60.18 濾液2 21.94 7.7×10 0.08 0.78×10-3
ⅲ.某些物質的溶解度(S):
Ⅰ.制備Li2CO3粗品T/℃ 20 40 60 80 100 S(Li2CO3)/g 1.33 1.17 1.01 0.85 0.72 S(Li2SO4)/g 34.7 33.6 32.7 31.7 30.9
(1)上述流程中為加快化學反應速率而采取的措施是。
(2)濾渣2的主要成分有。
(3)向濾液2中先加入EDTA,再加入飽和Na2CO3溶液,90℃充分反應后,分離出固體Li2CO3粗品的操作是。
Ⅱ.純化Li2CO3粗品
(4)將Li2CO3轉化為LiHCO3后,用隔膜法電解LiHCO3溶液制備高純度的LiOH。電解原理如圖所示,陽極的電極反應式是,該池使用了(填“陽”或“陰”)離子交換膜。請結合電極反應式,解釋高濃度LiOH溶液產生的原因:。后續再轉化得電池級Li2CO3。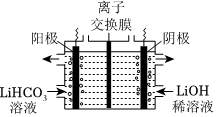
Ⅲ.制備LiFePO4
(5)將電池級Li2CO3和C、FePO4高溫下反應,生成LiFePO4和一種可燃性氣體,該反應的化學方程式是。組卷:2引用:1難度:0.4 -
19.某小組研究溶液中Fe2+與NO2-、NO3-的反應。
資料:[Fe(NO)]2+在溶液中呈棕色。實驗Ⅰ 試劑 現象 滴管 試管 
1 mol?L-1FeSO4溶液
(pH=4)1 mol?L-1 NaNO2溶液(pH=8) a.滴入1滴FeSO4溶液,溶液變黃色,繼續滴加,溶液變為棕色。2小時后,無明顯變化 1 mol?L-1NaNO3溶液(加NaOH溶液至pH=8) b.持續滴加FeSO4溶液,無明顯變化。
(1)研究現象a中的黃色溶液。
①用溶液檢出溶液中含有Fe3+。
②甲認為是O2氧化了溶液中的Fe2+.乙認為O2不是主要原因,理由是。
③進行實驗Ⅱ,裝置如圖。左側燒杯中的溶液只變為黃色,不變為棕色,右側電極上產生無色氣泡,經檢驗該氣體為NO.產生NO的電極反應式是。
實驗Ⅱ的目的是。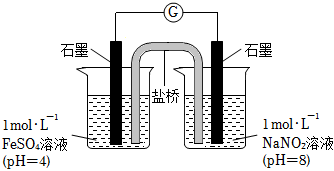
(2)研究現象a中的棕色溶液。
①綜合實驗Ⅰ和實驗Ⅱ,提出假設:現象a中溶液變為棕色可能是NO與溶液中的Fe2+或Fe3+發生了反應。進行實驗Ⅲ,證實溶液呈棕色只是因為Fe2+與NO發生了反應。實驗Ⅲ的操作和現象是。
②加熱實驗Ⅰ中的棕色溶液,有氣體逸出,該氣體在接近試管口處變為紅棕色,溶液中有紅褐色沉淀生成。解釋產生紅褐色沉淀的原因是。
(3)研究酸性條件下,溶液中Fe2+與NO2-、NO3-的反應。
①ⅰ中溶液變為棕色的離子方程式是序號 操作 現象 ⅰ 取1mol?L-1的NaNO2溶液,加醋酸至pH=3,加入1mol?L-1FeSO4溶液 溶液立即變為棕色 ⅱ 取1mol?L-1的NaNO3溶液,加醋酸至pH=3,加入1mol?L-1FeSO4溶液 無明顯變化 ⅲ 分別取0.5mL 1mol?L-1的NaNO3溶液與1mol?L-1的FeSO4溶液,混合,小心加入0.5mL濃硫酸 液體分為兩層,稍后,在兩層液體界面上出現棕色環 、。
②ⅲ中出現棕色的原因是。
實驗結論:本實驗條件下,溶液中NO2-、NO3-的氧化性與溶液的酸堿性等有關。組卷:234引用:3難度:0.1


