人教版(2019)選擇性必修1《第1章 化學反應的熱效應》2023年單元測試卷(10)
發布:2024/8/16 8:0:1
一、選擇題
-
1.室溫下將1mol的CuSO4?5H2O(s)溶于水會使溶液溫度降低,熱效應為△H1,將1mol的CuSO4(s)溶于水會使溶液溫度升高,熱效應為△H2;CuSO4?5H2O受熱分解的化學方程式為:CuSO4?5H2O(s)═CuSO4(s)+5H2O(l),熱效應為△H3.則下列判斷正確的是( )
A.△H2>△H3 B.△H1>△H3 C.△H1=△H2+△H3 D.△H1+△H2>△H3 組卷:1136引用:71難度:0.7 -
2.已知:H2O(g)═H2O(l)△H1
C6H12O6(g)═C6H12O6(s)△H2
C6H12O6(s)+6O2(g)═6H2O(g)+6CO2(g)△H3
C6H12O6(g)+6O2(g)═6H2O(l)+6CO2(g)△H4
下列說法正確的是( )A.△H1<0,△H2<0,△H3<△H4 B.6△H1+△H2+△H3-△H4=0 C.-6△H1+△H2+△H3-△H4=0 D.-6△H1+△H2-△H3+△H4=0 組卷:260引用:6難度:0.7 -
3.下列關于反應熱和焓變的說法正確的是( )
A.反應熱就是反應中放出的熱量 B.當反應放熱時△H>0,反應吸熱時△H<0 C.一個化學反應中,當反應物的總能量大于生成物的總能量時,反應放熱,△H為“-” D.一個化學反應中,生成物總鍵能大于反應物的總鍵能時,反應吸熱,△H為“+” 組卷:44引用:5難度:0.9 -
4.下列圖示變化為吸熱反應的是( )
A. 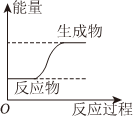
B. 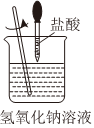
C. 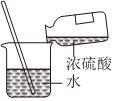
D. 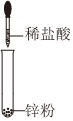 組卷:86引用:11難度:0.8
組卷:86引用:11難度:0.8 -
5.已知化學反應 S(1)+O2(g)═SO2(g),通常情況下,燃燒1moLS液體生成SO2氣體放出 293.23kJ 的熱量。分析下列說法中正確的是( )
A.1mol 固體 S 單質燃燒放出的熱量大于 293.23 kJ B.1mol氣體 S 單質燃燒放出的熱量小于 293.23 kJ C.1moLSO2(g)的鍵能的總和大于1moLS(1)和1molO2(g)的鍵能之和 D.1moLSO2(g)的鍵能的總和小于1moLS和1molO2(g)的鍵能之和 組卷:62引用:4難度:0.7 -
6.下列熱化學方程式的書寫正確的是(已知:氫氣、一氧化碳、乙醇、甲烷的標準燃燒熱分別為:-285.8 kJ?mol-1、-283.0 kJ?mol-1、-1366.8 kJ?mol-1、-890.3 kJ?mol-1)( )
A.2H2(g)+O2(g)=2H2O(g)△H=-571.6 kJ?mol-1 B.2CO(g)+O2(g)=2CO2(g)△H=-283.0 kJ?mol-1 C.C2H5OH(l)+2O2(g)=2CO2(g)+3H2O(l)△H=-1366.8 kJ D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1 組卷:54引用:5難度:0.8 -
7.反應A+B→C(△H<0)分兩步進行:①A+B=X(△H>0),②X→C(△H<0)。下列圖象能正確表示該反應過程中的能量變化的是( )
A. 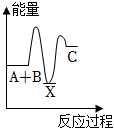
B. 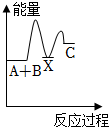
C. 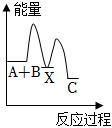
D. 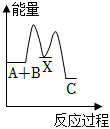 組卷:48引用:5難度:0.7
組卷:48引用:5難度:0.7 -
8.已知:S(g)+O2(g)═SO2(g);△H1
S(s)+O2(g)═SO2(g);△H2
2H2S(g)+O2(g)═2S(s)+2H2O(l);△H3
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l);△H4
SO2(g)+2H2S(g)═3S(s)+2H2O(l);△H5
下列關于上述反應焓變的判斷不正確的是( )A.△H1<△H2 B.△H3<△H4 C.△H5=△H3-△H2 D.2△H5=3△H3-△H4 組卷:176引用:10難度:0.7
四、解答題
-
24.根據有關要求回答問題:
(1)如圖1是1molNO2(g)和1molCO(g)反應生成CO2和NO過程中能量變化示意圖,若在反應體系中加入催化劑,反應速率增大,E1的變化是,ΔH的變化是(填“增大”、“減小”、“不變”)。請寫出NO2和CO反應的熱化學方程式:。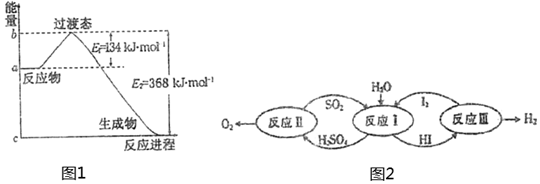
(2)以太陽能為熱源,熱化學硫碘循環分解水是一種高效、無污染的制氫方法。其反應過程如圖2所示。反應Ⅱ包含兩步反應:
第一步:H2SO4 (1)═SO3(g)+H2O(g) ΔH1=+177kJ/mol
第二步:2SO3(g)═2SO2(g)+O2(g) ΔH2=+196kJ/mol
①寫出第一步反應自發進行的條件是:。
②寫出反應Ⅱ的熱化學方程式:。組卷:12引用:2難度:0.4 -
 25.氯及其化合物在生活和生產中應用廣泛。
25.氯及其化合物在生活和生產中應用廣泛。
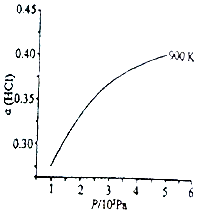
(1)已知:900K時,4HCl(g)+O2(g)?2Cl2(g)+2H2O(g),反應自發。
①該反應是反應(填“放熱”或“吸熱”)。
②900K時,體積比為4:1的HCl和O2在恒溫恒容的密閉容器中發生反應,HCl的平衡轉化率α(HCl)隨壓強(P)變化曲線如圖。保持其他條件不變,升溫到T K (假定反應歷程不變),請畫出壓強在1.5×105~4.5×105Pa范圍內,HCl的平衡轉化率α(HCl)隨壓強(P)變化曲線示意圖。
(2)已知:
Cl2(g)+2NaOH(aq)═NaCl(aq)+NaClO(aq)+H2O(l)△H1=-102kJ/mol
3Cl2(g)+6NaOH(aq)═5NaCl(aq)+NaClO3(aq)+3H2O(l)△H2=-422kJ/mol
①寫出在溶液中NaClO分解生成NaClO3的熱化學方程式:。
②用過量的冷NaOH溶液吸收氯氣,制得NaClO溶液(不含NaClO3),此時ClO-的濃度為c0mol/L;加熱時NaClO轉化為NaClO3,測得t時刻溶液中ClO-濃度為c1mol/L,寫出該時刻溶液中Cl-濃度的表達式;c(Cl-)=mol/L(用c0、c1表示)
③有研究表明,生成NaClO3的反應分兩步進行:
I.2ClO-═ClO2-+Cl-
II.ClO2-+ClO-═ClO3-+Cl-
常溫下,反應II能快速進行,但氯氣與NaOH溶液反應很難得到NaClO3,試用碰撞理論解釋其原因。
(3)電解NaClO3水溶液可制備NaClO4.在電解過程中由于陰極上吸附氫氣,會使電解電壓升高,電解效率下降。為抑制氫氣的產生,可選擇合適的物質(不引入雜質),寫出該電解的總化學方程式。組卷:13引用:2難度:0.6


