2023-2024學年浙江省湖州市安吉縣九年級(上)期中科學試卷
發布:2024/10/18 3:0:2
一、選擇題(本題有16小題,每小題3分,共48分。請選出各小題中一個符合題意的選項,不選、多選、錯選均不給分。)
-
1.鐵是目前人類使用最廣泛的金屬。下列過程中沒有發生化學變化的是( )
A.鐵絲燃燒 B.礦石煉鐵 C.鋼鐵生銹 D.鐵絲織網 組卷:5引用:1難度:0.5 -
2.pH是反映物質酸堿性強弱的指標。一些物質的pH范圍如下,其中呈酸性的是( )
A.廚房油污清洗劑 (12-13) B.84消毒液 (11-12) C.雞蛋清(7-8) D.檸檬汁 (2-3) 組卷:5引用:1難度:0.5 -
3.打開濃鹽酸試劑瓶時,能看到瓶口產生白霧且聞到刺激性氣味,說明濃鹽酸具有( )
A.揮發性 B.腐蝕性 C.吸水性 D.酸性 組卷:51引用:1難度:0.5 -
4.《易經》記載:“澤中有火”、“上火下澤”。這是對甲烷氣體在湖泊沼澤水面上起火現象的描述。下列有關甲烷的敘述,正確的是( )
A.甲烷的化學式為C2H4 B.甲烷燃燒只生成水 C.甲烷是天然氣的主要成分 D.甲烷與空氣的混合物,被點燃時不可能會發生爆炸 組卷:105引用:1難度:0.5 -
5.性質決定用途,用途反映性質。下列物質的用途與性質對應不正確的是( )
A.用氫氧化鋁治療胃酸過多——氫氧化鋁能與鹽酸發生反應 B.濕法煉銅——銅的金屬活動性比鐵強 C.用生石灰制作自熱盒飯的發熱材料——與水反應放熱 D.用氫氧化鈉吸收二氧化硫——氫氧化鈉能與二氧化硫反應 組卷:2引用:1難度:0.5 -
6.下列有關物質的化學式、名稱、俗名不完全對應的是( )
A.CaO 氧化鈣 消石灰 B.NaCl 氯化鈉 食鹽 C.Na2CO3 碳酸鈉 純堿 D.NaOH 氫氧化鈉 火堿 組卷:28引用:4難度:0.5 -
7.下列物質混合后,能發生復分解反應的是( )
A.氫氧化鎂、硫酸銅溶液 B.鹽酸溶液、氫氧化鋇溶液 C.碳酸鈉溶液、氯化鉀溶液 D.硫酸溶液、氯化鈉溶液 組卷:9引用:2難度:0.5 -
8.下列試管壁內殘留的固體物質不能用稀鹽酸除去的是( )
A.盛放過生銹鐵釘后留下的紅棕色固體 B.用氯化鋇試液檢驗硫酸后留下的白色固體 C.裝氧化銅粉末后留下的黑色固體 D.用澄清石灰水檢驗CO2后留下的白色固體 組卷:41引用:2難度:0.5 -
9.下列關于硫酸的說法錯誤的是( )
A.稀釋濃硫酸時,應將水注入濃硫酸中,并用玻璃棒攪拌 B.濃硫酸有強烈的腐蝕性 C.稀硫酸能使紫色石蕊試液變紅色 D.濃硫酸有吸水性,可作干燥劑 組卷:4引用:2難度:0.5 -
10.鈷(Co)的金屬活動性與鐵相似,鈷的化合物相關性質如表。下列預測合理的是( )
物質 CoO Co(OH)2 CoCl2 CoCO3 在水中的溶解性 難溶,灰綠色
固體難溶,粉紅色
固體易溶,溶液呈
粉紅色難溶,粉紅色
固體A.Co能從MgCl2溶液中置換出Mg B.CoO能與鹽酸反應得到粉紅色溶液 C.CoCO3能與鹽酸反應生成H2 D.Co(OH)2可由Co與NaOH溶液反應制得 組卷:208引用:13難度:0.5 -
11.下列各組物質,能在酸性溶液中大量共存,且溶液是無色、透明的是( )
A.Na2CO3,MgSO4,NaCl、K2SO4 B.CuSO4、KCl、NaNO3、CaCl2 C.Na2SO4、BaCl2、NaNO3、NaOH D.Na2SO4、KCl、Mg(NO3)2、AlCl3 組卷:23引用:3難度:0.7
四、解答題(本題有7小題,第29、30、31、32、33每小題各6分,第34小題8分,第35小題7分,共45分)
-
34.有一包白色固體可能含碳酸鈉、硫酸鈉、氯化鈉、硝酸鋇、氫氧化鉀中的一種或幾種。某科學興趣小組按以下操作檢測其成分:
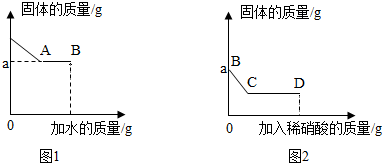
I.取少量固體于燒杯中,逐漸加水并不斷攪拌,燒杯內固體的質量隨加入水的質量的變化如圖1;
Ⅱ.繼續向燒杯中滴加稀硝酸并不斷攪拌,燒杯內固體的質量隨加入稀硝酸的質量的變化如圖2所示。
請回答下列問題:
(1)圖2中BC段可觀察到的現象是;
從C到D的過程中,液體的pH將逐漸(填“增大”、“減小”或“不變”);
到達D點時,溶液中含有的溶質有種(填“—”、“二”或“三”)。
(2)原白色固體中一定含有的物質是:。組卷:5引用:1難度:0.5 -
35.科學小組為測定某實驗廢液中硫酸銅和硫酸的質量分數,分別在三只燒杯中倒入50g廢液,并在燒杯中依次加入一定量的鐵粉。實驗結束后,測得的數據見如表:
請回答:第一組 第二組 第三組 反應前加入鐵粉質量/g 5.6 8.4 11.2 反應后剩余固體的質量/g 3.2 3.2 6.0 反應后產生氫氣(H2)的質量 0.1 0.2 0.2
(1)對比第一、二組數據,第一組實驗結束后,廢液中的(填化學式)已全部參加反應。
(2)計算50g廢液中所含硫酸的質量分數為多大。
(3)計算第二組反應完全后,所得溶液的溶質質量分數。組卷:21引用:1難度:0.5


