2020-2021學年吉林省延邊二中高一(下)第一次段考化學試卷
發布:2024/12/23 2:30:2
一、單項選擇題(20小題,每小題3分,共60分)
-
1.《厲害了,我的國》展示了中國探索太空,開發深海,建設世界第一流的高鐵、橋梁、碼頭,5G技術聯通世界等取得的舉世矚目的成就。它們與化學有著密切聯系。下列說法正確的是( )
A.制造手機芯片的關鍵材料是二氧化硅 B.“神舟十一號”宇宙飛船返回艙外表面使用的高溫結構陶瓷的主要成分是硅酸鹽 C.我國提出網絡強國戰略,光纜線路總長超過三千萬公里,光纜的主要成分是晶體硅 D.C919大型客機使用了大量先進復合材料、鋁鋰合金等,鋁鋰合金可減輕機身自重 組卷:46引用:9難度:0.7 -
2.碳納米管是繼足球烯(C60)以后發現的又一種碳單質,以下有關碳納米管與足球烯(C60)的說法錯誤的是( )
A.它們的物理性質有較大差異 B.在常溫下它們的化學性質都穩定 C.它們是不同的碳單質 D.它們分別完全燃燒后生成物不同 組卷:71引用:6難度:0.8 -
3.下列有關硅及其化合物的敘述錯誤的是( )
A.氫氟酸可用于刻蝕石英玻璃,說明二氧化硅是堿性氧化物 B.水玻璃是制備硅酸和木材防火劑的原料 C.碳化硅俗稱金剛砂,可用作砂紙和砂輪的磨料 D.漢代燒制出“明如鏡、聲如磬”的瓷器,其主要原料為黏土 組卷:11引用:1難度:0.7 -
4.下列有關濃硫酸的敘述正確的有幾項( )
①濃硫酸在常溫下能夠使鐵、鋁等金屬鈍化
②濃硫酸與銅加熱反應后,銅片有剩余,硫酸完全反應
③濃硫酸具有吸水性,因而能使蔗糖炭化
④濃硫酸與銅加熱反應后,銅片有剩余,向反應后的溶液中再加入鐵片,會有氫氣生成
⑤濃硫酸是一種干燥劑,能夠干燥氨氣、氫氣等氣體
⑥濃硫酸與鐵加熱反應后,鐵片有剩余,生成的氣體除水蒸氣外只有SO2
⑦濃硫酸具有強氧化性,常溫下能與Cu發生劇烈反應
⑧濃硫酸具有強氧化性,SO2具有還原性,所以濃硫酸不能干燥SO2
⑨向5mL18mol?L-1的濃硫酸中加入足量Cu并加熱使其充分反應,被還原的H2SO4和生成的SO2氣體均小于0.045molA.一項 B.兩項 C.三項 D.四項 組卷:17引用:1難度:0.6 -
5.下列說法正確的是( )
A.在膽礬晶體中加入濃H2SO4后出現變白現象,說明濃硫酸具有脫水性 B.檢驗SO42-時,向試樣中先加入稀HCl,再加入Ba(NO3)2溶液,觀察是否有白色沉淀產生 C.濃硫酸與過量的鋅反應,可以得到無色具有刺激性氣味的混合氣體 D.檢驗NH4+時,向試樣中加入NaOH溶液,用濕潤的紅色石蕊試紙檢驗生成的氣體 組卷:7引用:1難度:0.6 -
6.粗鹽中含有Ca2+、SO42-等可溶性雜質和泥沙等不溶性雜質。實驗室用如圖方案模擬粗鹽的精制,下列說法正確的是( )
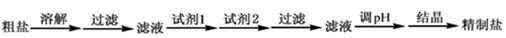
A.過濾操作中必須用到的玻璃儀器有燒杯、玻璃棒和分液漏斗 B.試劑1可選用Na2CO3溶液,試劑2可選用BaCl2溶液 C.檢驗SO42-是否沉淀完全可向相應的上清液中繼續滴加2~3滴BaCl2溶液,觀察現象 D.結晶時,應先加熱蒸發形成較高溫度下的飽和溶液,然后冷卻到室溫 組卷:3引用:1難度:0.6 -
7.下列指定反應的離子方程式正確的是( )
A.室溫下用稀NaOH溶液吸收Cl2:Cl2+2OH-═ClO-+Cl-+H2O B.用氨水除去少量的SO2廢氣:NH3?H2O+SO2═NH4++HSO3- C.室溫下用稀HNO3溶解銅:Cu+2NO3-+2H+═Cu2++2NO2↑+H2O D.向Na2SiO3溶液中滴加稀鹽酸:Na2SiO3+2H+═H2SiO3↓+2Na+ 組卷:13引用:1難度:0.6 -
8.下列各實驗的現象及結論都正確的是( )
選項 實驗 現象 結論 A 濃硫酸滴入蔗糖中,產生的氣體導入澄清石灰水 蔗糖變 黑、體積膨脹,澄清石灰水變渾濁 濃硫酸具有脫水性和強氧化性 B 銅粉加入稀硫酸中,加熱;再加入少量硝酸鉀固體 加熱時無明顯現象,加入硝酸鉀后溶液變藍 硝酸鉀起催化作用 C 過量鐵粉加入稀硝酸中,充分反應后,滴加KSCN溶液 有無色氣泡產生,溶液呈血紅色 稀硝酸能將Fe氧化成Fe3+ D 將Na粒投入MgCl2溶液 析出銀白色固體 固體為Mg A.A B.B C.C D.D 組卷:401引用:9難度:0.5
二、填空題(共40分)
-
23.氮的氧化物(NOx)是大氣污染物之一,工業上在一定溫度和催化劑條件下用NH3 將NOx還原生成N2.某同學在實驗室中對NH3與NO2反應進行了探究。回答下列問題:
(1)氨氣的制備
①氨氣的發生裝置可以選擇上圖中的,反應的化學方程式為
②欲收集一瓶干燥的氨氣,選擇上圖中的裝置,其連接順序為:發生裝置→
(2)氨氣與二氧化氮的反應(按氣流方向,用小寫字母表示)。
將上述收集到的 NH3 充入注射器 X 中,硬質玻璃管 Y 中加入少量催化劑,充入NO2(兩端用夾子 K1、K2 夾好)。在一定溫度下按圖示裝置進行實驗。操作步驟 實驗現象 解釋原因 打開K1,推動注射器活塞,使X中的氣體緩慢充入Y管中 ①Y管中 ②反應的化學方程式 將注射器活塞退回原處并固定,待裝置恢復到室溫 Y管中有少量水珠 生成的氣態水凝聚 打開K2 ③ ④ 組卷:139引用:10難度:0.5 -
24.亞硝酰氯(NOCl,熔點:-64.5℃,沸點:-5.5℃)是一種黃色氣體,遇水易水解。可用于合成清潔劑、觸媒劑及中間體等。實驗室可由氯氣與一氧化氮在常溫常壓下合成。
(1)甲組的同學擬制備原料氣NO和Cl2,制備裝置如圖所示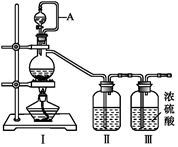
為制備純凈干燥的氣體,表中缺少的藥品是:
(2)乙組同學利用甲組制得的NO和Cl2制備NOCl,裝置如圖所示:裝置Ⅰ 裝置Ⅱ 燒瓶中 分液漏斗中 制備純凈Cl2 MnO2 ① ② 制備純凈NO Cu ③ ④ 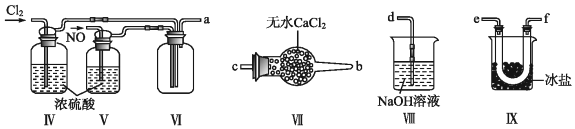
①裝置連接順序為a→(按氣流自左向右方向,用小寫字母表示)。
②裝置 IV、V 除可進一步干燥NO、Cl2外,另一個作用是。
③裝置 VII的作用是。
④裝置 VIII中吸收尾氣時,NOCl發生反應的化學方程式為。
(3)丙組同學查閱資料,查得王水是濃硝酸與濃鹽酸的混酸,一定條件下混酸可生成亞硝酰氯和氯氣,該反應的化學方程式為。組卷:51引用:8難度:0.5


