2022年江蘇省徐州七中高考化學模擬試卷(二)
發布:2024/4/20 14:35:0
一、單項選擇題:共14題,每題3分,共4分。每題只有一個選項符合題意。
-
1.我國提出2060年實現“碳中和”。下列有關做法不利于“碳中和”的是( )
A.減少糧食釀酒 B.重油裂化 C.CO2合成淀粉 D.推廣氫燃料電池汽車 組卷:39引用:2難度:0.6 -
2.在陽光照射下,水和氧氣在浸泡過KOH溶液的三噻吩(C12H8S3)聚合物表面能高效合成過氧化氫(H2O2),下列說法不正確的是( )
A.H2O2的電子式為:H+ 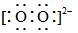 H+
H+B.H2O為極性分子 C.KOH為離子晶體 D.S2-的結構示意圖為 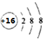 組卷:28引用:4難度:0.7
組卷:28引用:4難度:0.7 -
3.閱讀下列資料,完成4~6題:氯氣及其化合物在生產生活中用途十分廣泛。氯堿工業通過電解飽和食鹽水制備氯氣。實驗室用高錳酸鉀和濃鹽酸反應制取氯氣,其反應原理為2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O
下列含氯物質的性質與用途具有對應關系的是( )A.ClO2具有氧化性,可用于自來水的殺菌消毒 B.NaCl易溶于水,可用于工業電解制備金屬鈉 C.CCl4密度大于水,可用作鹵素單質的萃取劑 D.聚氯乙烯具有可燃性,可用于制造塑料薄膜 組卷:13引用:0難度:0.70 -
4.閱讀下列資料,完成4~6題:氯氣及其化合物在生產生活中用途十分廣泛。氯堿工業通過電解飽和食鹽水制備氯氣。實驗室用高錳酸鉀和濃鹽酸反應制取氯氣,其反應原理為2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O
下列有關氯堿工業的說法正確的是( )A.電解池的陽極材料由碳鋼網制成 B.每生成1 mol Cl2轉移電子數約為2×6.02×1023 C.獲得的主要產品除Cl2外,還有純堿和H2 D.工業上可用澄清石灰水吸收Cl2聯合生產漂白粉 組卷:7引用:0難度:0.70 -
5.閱讀下列資料,完成4~6題:氯氣及其化合物在生產生活中用途十分廣泛。氯堿工業通過電解飽和食鹽水制備氯氣。實驗室用高錳酸鉀和濃鹽酸反應制取氯氣,其反應原理為2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O
實驗室用如圖裝置制取少量Cl2,其中能達到相應實驗目的的是( )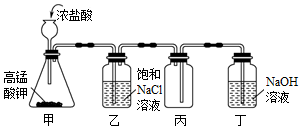
A.用裝置甲生成Cl2 B.用裝置乙除去Cl2中的HCl C.用裝置丙收集Cl2 D.用裝置丁吸收Cl2尾氣 組卷:32引用:0難度:0.80
二、非選擇題:共4題,共58分。
-
17.以酸性蝕刻液(主要含CuCl42-和H+)和堿性蝕刻液[主要含Cu(NH3)42+和Cl-]制備硫酸銅,并回收氯化銨的實驗流程如圖:
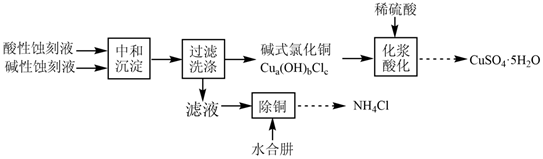
(1)將一定量酸性蝕刻液和堿性蝕刻液加入到三頸燒瓶(裝置如圖),通入NH3或HCl調節溶液pH在5.5左右,充分中和后,獲得堿式氯化銅沉淀。實驗中球形干燥管的作用是。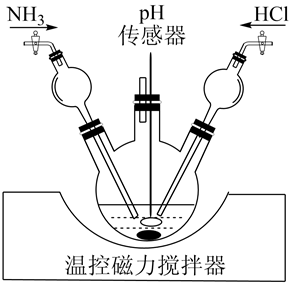
(2)為確定酸化時加入稀硫酸的用量,需測定堿式氯化銅的組成,請補充實驗方案:
I.取一定質量的堿式氯化銅固體,測定其中Cu元素的質量(具體步驟省略);
II.另取相同質量的堿式氯化銅固體,,低溫干燥至恒重。(可選用的試劑:2mol?L-1鹽酸、2mol?L-1硝酸、AgNO3溶液、蒸餾水)
(3)①化漿酸化后經結晶得硫酸銅粗品,其中含有的主要雜質是(填化學式)。
②將硫酸銅粗品溶于熱水形成飽和溶液,加入適量乙醇攪拌,冷卻后過濾,洗滌,可制得高純度CuSO4?5H2O。加入乙醇的目的是。
(4)向濾液中加入水合肼(N2H4?H2O)除去殘留的Cu2+,再經結晶獲得副產品氯化銨。除銅時,溶液pH控制在6~7為宜。若溶液pH大于8,Cu2+的去除率反而下降,其原因是。組卷:47引用:3難度:0.5 -
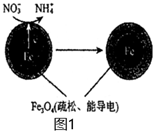 18.地下水中硝酸鹽造成的氮污染已成為一個世界性的環境問題。水體除NO3-主要有電化學法、催化還原法等。
18.地下水中硝酸鹽造成的氮污染已成為一個世界性的環境問題。水體除NO3-主要有電化學法、催化還原法等。
(1)電化學去除弱酸性水體中NO3-的反應原理如圖1所示:
①正極的電極反應式是。
②取兩份完全相同的含NO3-廢液A和B,調節廢液A、B的pH分別為2.5和4.5,向廢液A、B中加入足量鐵粉,經相同時間充分反應后,廢液A、B均接近中性。廢液A、B中鐵的最終物質形態分別如圖2所示。溶液的初始pH對鐵的氧化產物有影響,具體影響為。pH=4.5,NO3-的去除率低的原因是。
(2)納米Fe-Ni去除廢液中的NO3-(Ni不參與反應)。初始pH pH=2.5 pH=4.5 NO3-去除率 接近100% <50% 24小時pH 接近中性 接近中性 鐵的最終物質形態 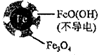
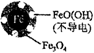
①在酸性條件下,Fe與NO3-反應生成Fe2+和NH4+,則反應的離子方程式為。
②初始pH=2.0的廢液,加入一定量的納米Fe-Ni,反應一段時間后,廢液中出現大量白色絮狀沉淀物,過濾后白色沉淀物在空氣中逐漸變成紅褐色。產生上述現象的原因是。
(3)在金屬Pt、Cu和(銥)的催化作用下,H2可高效轉化酸性溶液中的NO3-,其工作原理如圖2所示。H2在金屬Pt和Cu的催化作用下將NO3-轉化為液體中N2O得過程可描述為。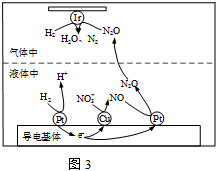 組卷:28引用:1難度:0.5
組卷:28引用:1難度:0.5


